转自: 康成生物资讯(微信公众号)
今天小编为各位解析题为“Extensive translation of circular RNAs driven by N6-methyladenosine”的文章,通讯作者为中科院上海计算生物学研究所王泽峰教授。文章报道了,人细胞中的m6A修饰——这一RNA中丰度最高的碱基修饰,能有效地起始circRNA的蛋白翻译。作者发现,circRNA上有公认的m6A motif富集,而一个m6A位点就足够启动翻译的起始。这个m6A启动的翻译需要起始因子eIF4G2和m6A识别蛋白YTHDF3,同时能被甲基转移酶METTL3/14加强,能被去甲基化酶FTO抑制,也能被热激上调。通过polysome profiling、电脑预测以及质谱实验发现,m6A驱动的circRNA翻译是广泛存在的,有数百个内源的circRNA都有翻译潜能。作者的研究,拓宽了人类转录组的研究,同时也提示了一种circRNA来源的蛋白在应对环境压力中的角色。

Introduction
目前关于circRNA的研究,主要报道其能作为诱饵吸附miRNA(比如miRNA海绵)或结合和隔离一些RNA结合蛋白,然而大部分的circRNA的生物学功能仍然未知。一个很有趣的可能是,circRNA能翻译蛋白,因为绝大部分的circRNA是由外显子构成的,且circRNA主要分布在细胞质中。事实上,含有内部核糖体进入位点(internal ribosomal entry site, IRES)的人工circRNA在体外或体内都可以翻译。然而circRNA的编码潜能仍然是个开放的问题,因为很早前的报道中提到,绝大部分的circRNA与多核糖体没有什么关联。
m6A是真核生物中丰度最高的RNA修饰。这个修饰偏向于发生在一个公认的motif基序“RRm6ACH”(R=G或A;H=A, C或U),通过MeRIP Seq,共在人和小鼠中发现了超过7000个mRNA和300个非编码RNA有m6A修饰。腺嘌呤(A)的甲基化是由METTL3\METTL14和Wilms’肿瘤1相关蛋白构成的甲基转移酶复合体催化形成。m6A的去甲基化可由FTO(fat mass and obesity-associated protein)和AKLBH5(alkylated DNA repair protein alkB homolog 5)催化。细胞中,m6A能被YTH结构域家族蛋白YTHDF1,2和3识别和结合,他们即是m6A的识别蛋白。m6A修饰能影响多个阶段的RNA代谢,包括mRNA定位、剪接、翻译和降解,反过来调控重要的生物学过程比如干细胞分化。特别地,m6A对翻译有多方面的影响:3‘ UTR上的m6A能通过被YTHDF1结合后,能提高翻译效率,然而5‘ UTR上的m6A通过YTHDF2蛋白机制促进热激作用下的帽子非依赖翻译。此外,近期有报道称YTHDF3通过与YTHDF1协同作用促进蛋白合成,而胞质中的YTHDF3与核糖体蛋白相互作用促进mRNA翻译也进一步支持前面的发现。然而,m6A对mRNA翻译的一般作用仍然是个不完整的故事,细节的机制仍然未知。
本文报道人细胞中的circRNA通过一段含有m6A位点的短序列作为IRES而有限地翻译。FTO能减少circRNA的翻译,甲基转移酶METTL3/14能促进翻译,同时需要真核生物翻译起始因子eIF4G2和m6A识别蛋白YTHDF3。
Results
有m6A motif的circRNA能在细胞内翻译
早前,作者构建了一个minigene报告基因,包含有split GFP来证明用病毒IRES 能启动circRNA的翻译(下图A)。作者插入了人基因组中几种内源IRES或对照序列的circRNA,检测是否也能翻译。令人惊讶的是,所有插入序列,包括3个38-253nt的阴性对照,都能有效地起始GFP翻译(下图B)。
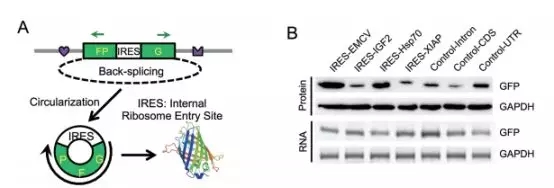
让作者很疑惑的是为什么插入阴性对照也能诱导circRNA翻译,作者研究了翻译起始位点附近的序列。结果发现,所有的阴性对照都在起始密码子附近含有一个RRACH motif,使其带上m6A修饰(下图左)。因为m6A被报道能提高mRNA翻译的效率,作者猜测含有m6A的RRACH序列或许参与了circRNA翻译的起始。为了验证这个假设,作者在circRNA报道基因起始密码子的前面插入了一小段含有不同拷贝数的m6A motif序列,同时检测在转染的293细胞中GFP蛋白的产量。与预期相符,含有1个或2个m6A motif的circRNA就能有限地翻译出GFP蛋白,而含有突变motif的细胞中,产量则显著减少(下图右)。此外,含2个m6A motif序列的circRNA与含1个motif序列的circRNA相比,其翻译效率相似,说明独立的一个m6A位点就足够起始翻译了。当插入任何不含腺嘌呤(A)的序列后,circRNA的翻译都消失。除此之外,作者试验了两个被报道能发生m6A修饰的序列,RSV和RSVns,结果发现这两个序列也能强烈地诱导circRNA翻译。重要地是,降低m6A甲基化的序列同时能降低翻译效率,也更加证明了m6A驱动了circRNA的翻译。

作者在Hela细胞中的研究也发现了circRNA的翻译,这意味着m6A起始的circRNA翻译是不受细胞类型限制。但是,在Hela细胞中,即使是突变的m6A motif,也仍然有一些GFP蛋白的表达。这或许是因为m6A发生在了非经典的位点或者是在Hela细胞中其他一些序列可以起始m6A依赖的circRNA翻译。
调控circRNA的m6A水平影响翻译效率
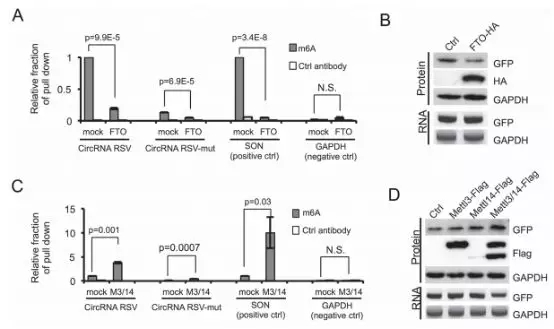
为了进一步研究m6A对于circRNA翻译的重要作用,作者通过RNA-IP检测含有m6A motif的circRNA是否真的被甲基化了。结果显示,识别m6A位点的抗体特异性地富集到了含有RSV m6A位点的circRNA以及一个已知的含有m6A修饰的mRNA(SON mRNA),没有富集到未含有m6A的对照mRNA。含有突变m6A位点的circRNA(RSV-mut)也同样被富集到了,但含量非常低。这个研究表明,突变能降低RSV上的m6A修饰但不能完全去除该修饰,这与插入RSV-mut 报告基因的circRNA中有少量GFP表达的结果一致。亦或者,在circRNA中还有其他小的m6A位点。此外,共表达m6A去甲基化酶FTO能显著减少免疫沉淀的SON mRNA或含有RSV的circRNA的富集水平,也能降低从circRNA上翻译GFP(下图A&B),进一步确认circRNA/mRNA的m6A位点的确发生了甲基化,同时circRNA的翻译的确是m6A起始的。与这些发现一致的是,共表达甲基转移酶METTL3/14能显著增加含有m6A位点的circRNA或mRNA的RNA RIP信号,且能显著增加circRNA的蛋白翻译(下图C&D)。
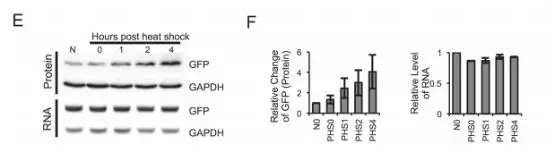
m6A甲基化在热击压力下会影响mRNA的翻译。参考了这个思路,作者在42℃ 1h处理后又恢复到37℃的细胞中发现了含有m6A的circRNA翻译的蛋白量上升,而GFP circRNA的水平并未发生变化(下图)。这个发现表明,m6A介导的蛋白翻译,尤其是从circRNA的翻译,或许是细胞应激反应的一个重要参与者。一个可能的机制是,在热击作用下胞质中的YTHDF2转位至细胞核内,封闭了m6A去甲基化酶FTO,增加了circRNA上的m6A修饰水平,进而增强了circRNA的翻译。亦或者,热击压力广泛地减少了帽子依赖的翻译,引起细胞都转向了通过IRES的非帽子依赖的翻译,因此circRNA非帽子依赖的翻译也就相应增加了。
m6A起始的circRNA翻译需要蛋白因子的参与
circRNA翻译需要通过一种和线性RNA翻译完全不一样的机制。真核生物的翻译是eIF4复合体起始的,eIF4E与mRNA的帽子结合,同时eIF4G作为蛋白结合支架组装起始复合体。紧接着,激活的40S 核糖体亚基在eIF3结合eIFG4后被招募至mRNA处(下图A左)。在帽子非依赖的翻译中,在eIF4E不存在的情况下,一个非典型的eIF4G蛋白(eIF4G2)直接识别一个IRES并起始eIF4复合体组件,引起翻译的起始(下图A右)。为了深入理解m6A驱动的circRNA翻译,作者研究了circRNA翻译起始中eIF4G2的参与。用两个稳定的表达有eIF4G2 shRNAs的细胞株(下图B),作者检测了circRNA或者mRNA编码的GFP的表达。与预期相符,eIF4G2缺失显著降低了circRNA的蛋白翻译,但是并未影响线性mRNA的翻译(下图C)。相似地,eIF2A,一个eIF3的亚基与病毒IRES结合,适宜地降低了circRNA的翻译,但是并未影响线性mRNA的翻译(下图D&E)。最后综合各种结果,作者得出结论,circRNA的翻译是通过一个依赖于eIF4G2的机制。
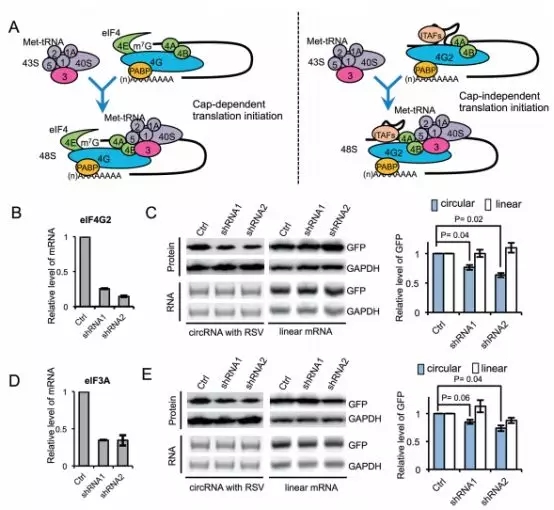
接下来,作者研究了含有m6A的circRNA的翻译是否需要m6A识别蛋白。作者发现,RNAi处理后的YTFDF1的缺失不会影响circRNA的翻译,而YTHDF2的缺失会轻微地抑制线性RNA和circRNA的GFP翻译。然而,YTHDF3的缺失则显著抑制了circRNA的GFP翻译,但不影响线性RNA的翻译,这提示说YTHDF3对于m6A驱动的circRNA翻译是必须的。与此一致的是,免疫共沉淀结果显示,YTHDF3能直接与eIF4G2相互作用,提示YTHDF3可能在招募eIF4G2至含有m6A的RNA中扮演一定的角色。
此外,作者通过基因组分析多种起始因子的结合位点、,转录组范围内的m6A检测、翻译起始位点(TIS)比对等方法来研究体内circRNA分子的可能翻译情况。研究表明,eIF4G2和eIF3A倾向于结合在有m6A和TIS的circRNA,这与前面发现这些因子可以促进circRNA翻译相一致。与预期一致,eIF4G2的结合位点经常与预测到的TIS附件的m6A修饰相重合(下图)。
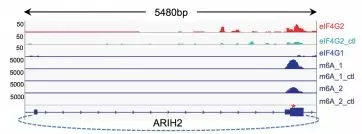
鉴定内源的含有m6A修饰的circRNA
通过m6A IP结合高通量测序的方法,作者共鉴定到85个含有m6A修饰的circRNA。根据m6A IP vs 总input中circRNA reads的分布,作者预测13%的circRNA有m6A修饰。鉴于作者的实验设计和分析过于严格,这个数据或许是个保守的估计,因为作者的实验只有一部分含有m6A位点的被IP富集到,且只有back-splice junction附近的m6A位点才被认为是circRNA reads。尽管如此,这些数据仍能说明,circRNA存在着大量的m6A甲基化修饰。
人转录组中普遍存在着有编码潜能的circRNA
根据以上的研究,作者开发了一个流程,通过一系列过滤设置,预测内源性的有翻译潜能的circRNA。以从Hs68细胞的RNase R处理后的RNA seq中得到的7771个circRNA作为起始,作者首先鉴定了623含有m6A peak的circRNA,又进一步通过pre-mapped TIS的过滤设置,将候选者缩小至124个circRNA。最后挑选了25个有足够长ORF(≥150nt或编码超过50个aa的蛋白)的circRNA。进一步通过多核糖体检测把从25个circRNA中挑选的12个进行试验验证,发现其中有10个的确与多核糖体相关。作者认为这些通过严格过滤的25个circRNA只代表了培养细胞中有翻译潜能的circRNA的一小部分。深入地研究还会增加有翻译潜能circRNA检测的灵敏度。
作者又通过实验去寻找人转录组中正在进行活跃翻译的circRNA。作者首先用蔗糖梯度离心的方法纯化多核糖体相关的RNAs,紧接着用RNase R处理纯化得到的RNA,然后进行高通量测序。测序reads比对到人基因祖上,用CIRCexplorer鉴定back-splice junction。作者发现有250个circRNA与多核糖体有作用。前面预测到的25个circRNA中,只有一个在polysome profiling/circRNA中找到。提示作者的方法,并没有饱和。
作者进一步用RT-PCR研究了单核糖体和多核糖体相关的circRNA,并且确认,7个试验的circRNA都与核糖体相关,其中5个与核糖体结合的碱基数目比没结合的碱基数目要多。对于一些circRNA,很长的片段都与核糖体相关,提示这些circRNA在活跃的翻译中。用能特异性干扰活跃翻译核糖体的腺嘌呤素处理,发现与多核糖体相关的circRNA显著减少,提示与多核糖体相关的circRNA就是因为活跃的翻译。综合以上,作者的研究表明,人转录组普遍存在着有编码潜能的含m6A的circRNA。
CircRNA junction上翻译的内源性肽段
为了直接鉴定由circRNA编码的内源性蛋白,作者开发了一个包含跨越所有已知circRNA back-splice junction序列所编码的肽段的数据库,将之与人蛋白数据库UniProt联合,检测293细胞裂解物的MS/MS结果。
作者鉴定到了33个circRNA back-splice junction编码的肽段,它们不与UniProt数据库中任何蛋白匹配。MS/MS质谱展示两个代表样品结果。为了进一步验证候选的circRNA编码的肽段,作者化学合成了其中两条circRNA编码的肽段,并且用这两个肽段做了MS/MS。这两个化学合成的肽段的MS/MS结果与细胞裂解物中原始肽段的MS/MS结果近似匹配,提示蛋白组学分析发现的肽段很可能是circRNA翻译产生的。
Discuss
circRNA有大量的m6A修饰,足够去驱动一种由m6A识别蛋白YTHDF3和翻译起始因子eIF4G2参与的非帽子依赖的蛋白翻译(下图)。同时,很多circRNA被发现是与多核糖体相关的,提示有相当数量的内源性circRNA是翻译的。circRNA-m6A-seq仍能告诉我们m6A修饰在circRNA中很普遍的,提示我们,在人的转录组中,可翻译的circRNA是普遍存在的。这个结果挑战了把circRNA当做非编码RNA的刻板观点,同时也开启了circRNA潜在功能的新研究方向。
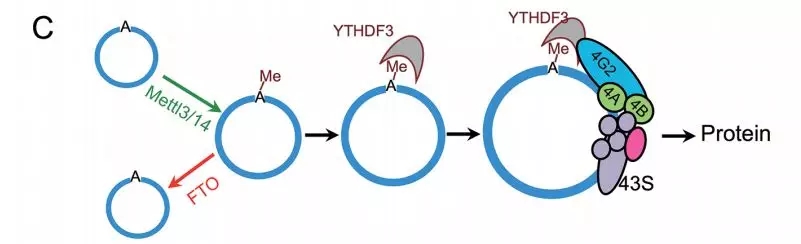
这些发现同时引出一些很有趣的问题,比如,circRNA编码蛋白可能的功能是什么。作者发现在热激条件下,circRNA的翻译是增加的,增加了circRNA编码蛋白在压力反应中扮演一定角色的可能性。有报道说,在癌症中,非帽子依赖的通过IRES进行的翻译是上升的,以促进基因的翻译。这一机制在细胞应激反应、发展、凋亡及细胞周期调控中发挥重要作用。因为circRNA是能通过非帽子依赖的途径进行翻译,因此作者推测circRNA的翻译在癌细胞中可能很流行,当然这依然是个待确定的问题。此外,很多circRNA编码N终端蛋白片段,能产生与传统翻译蛋白有重叠序列的蛋白异构体。结果,有可能circRNA编码的蛋白异构体干扰相对经典的蛋白的功能。同时,作者也发现一些短的没有公认m6A motif序列也可以驱动circRNA的翻译,意味着circRNA翻译也可被一些非m6A依赖的机制驱动,或者是腺嘌呤的甲基化也可在非经典位点发生。
此前一些非编码RNA被报道有5’ORF编码的潜能,然而体内的m6A驱动的非帽子依赖的翻译提示了另外一种更有说服力的非编码RNA从内部ORF开始的翻译。因此,一个细胞的翻译图谱可能会对我们目前认为的更加复杂。就如一个基因可以通过可变剪接产生多个mRNA异构体一样,作者推测非帽子依赖的翻译也可使一个mRNA被翻译成多个不同的蛋白。





来第一个抢占沙发评论吧!