写在前面
因为灰常灰常想报考的研究生老师在做circRNA方面研究,但是很惭愧对这一方面知之甚少,所以暑假想看一些文章补一补,又因为记性不太好,就干脆翻译了出来加深印象,错漏之处望批评指正~
这是最近发表在Nature Review Genetics一篇关于circRNA的综述,虽然比较长,但是层次分明,我觉得很适合对circRNA感兴趣,但是了解不多的朋友看一看,依次介绍了circRNA的产生、特性、探测和分析方法、生物功能和功能研究方法,看官可以选择自己感兴趣的部分阅读。
环形RNA的生物发生、生物学和表征
Kristensen LS et al. The biogenesis, biology and characterization of circular RNAs. Nat Rev Genet. (2019)
摘要
正文
circRNA的生物发生和特性
cirRNA的生物发生
circRNA的特性
发现和分析circRNA
circRNA全基因组分析
circRNA位点特异性分析
circRNA可视化
circRNA的生物学功能
单个circRNA作为miRNA海绵
单个circRNA通过与蛋白质的相互作用发挥功能
多个circRNA与蛋白质相互作用的协同作用
翻译的circRNA的功能
确定circRNA功能的方法
表征circRNA-miRNA相互作用的方法
表征circRNA-蛋白质相互作用的方法
研究circRNA翻译的方法
RNAi敲降circRNA
敲除circRNA
过表达circRNA
总结和未来展望
摘要
环状RNA(circRNA)是真核生物中共价闭合的内源生物分子,具有组织特异性和细胞特异性表达模式,其生物发生受特定顺式作用元件和反式作用因子的调节。一些circRNA很丰富,在进化上是保守的,许多circRNA通过作为miRNA或蛋白质抑制剂(“海绵”)、调节蛋白质功能或使自身翻译而发挥重要的生物学功能。此外,circRNA与糖尿病,神经障碍,心血管疾病和癌症等疾病有关。虽然这些转录本的环状性质使其在检测,定量和功能表征上具有挑战性,但高通量RNA测序和专门的circRNA计算工具的新进展推动了最先进的cirRNA鉴定方法的发展,新的功能表征的方法也正在出现。
正文
cirRNA是非编码RNA中的一大类,它由一种非经典剪接方式——反向剪接(backsplicing)产生;当反向剪接发生时,下游剪接位点与上游剪接位点共价连接闭合。虽然类病毒不是由反向剪接机制产生的,但是它们是40多年前首次发现的环状RNA分子。几年后,通过电子显微镜在真核细胞系的细胞质组分中观察到circRNA。然而当时它们主要被认为是由异常剪接事件产生的“垃圾”,只有来自性别决定区Y(Sry)基因的睾丸特异性circRNA被认为可能具有功能(在小鼠睾丸中)。近年来,高通量RNA测序(RNA-seq)和circRNA特异性生物信息学算法已经在真核生物中鉴定了数千种circRNA,包括真菌,原生生物,植物,蠕虫,鱼类,昆虫和哺乳动物,并且发现它们具有组织 特定的表达模式。
类病毒 Viroids
小的,环状的单链RNA分子(246-401个核苷酸),未包被且不编码蛋白质。它们对高等植物具有致病性
绝大多数cirRNA由已知的蛋白质编码基因表达,由单个外显子或多个外显子构成。由线性RNA的所有基本类型的可变剪接产生的产物都可以在circRNA中发现,而一些circRNA包含的外显子在线性转录本中却没有。尽管缺乏聚腺苷酸化(poly(A))和加帽,但circRNA通常定位于细胞质。然而,内部的内含子保留可能导致产生含来自外显子和内含子序列的circRNA(称为exon-intron circRNA),并且在经典的剪接过程中内含子套索的脱支失败可导致环状内含子RNA(ciRNA)产生;exon-intron circRNA和ciRNAs位于细胞核中,这些circRNA通过与U1小核核糖核蛋白(snRNP;例如circEIF3J和circPAIP2)的相互作用或通过正调节RNA聚合酶II介导的转录(Pol II)促进其亲本基因的转录(如ci-ankrd52)。
虽然反向剪接一般不如线性剪接的效率高,但是circRNA具有很高的稳定性,可以以时间调节的方式在特定的细胞类型中累积。这种高稳定性想必是它们共价闭合的环结构保护这些分子免受核酸外切酶介导的降解的结果。尽管circRNA通常表达的水平低于其线性对应物,但对于许多基因而言,circRNA是主要的转录物,并且大多数产生circRNA的基因座可能存在经典剪接和反向剪接之间的竞争。有趣的是,大量的circRNA在神经发生过程中被上调,并且一些circRNA在突触中富集。然而,尽管已经提出了circRNA在发育过程中神经元中的许多不同功能和作用机制,但是是否一般终末分化的细胞(例如神经系统中的细胞)更活跃地产生circRNA,又或者由于circRNA的高稳定性导致其在非增殖细胞中累积,还不清楚。与神经组织相比,circRNA通常在癌症和其他细胞增殖率高的疾病中下调,可能是因为它们在达到稳定水平之前被增殖稀释。迄今为止,circRNA已经涉及多种人类疾病,包括糖尿病,神经系统疾病,心血管疾病,慢性炎症性疾病和癌症(方框 1:疾病中的circRNA),并且circRNA在衰老期间累积。
本综述介绍了我们对circRNA生物发生和生物学理解的最新进展,并描述了将进一步推动这一快速发展的研究领域的现代技术。特别地,我们描述了可以对circRNA进行准确定量和功能表征的新方法。
方框1:疾病中的circRNA
由于最近发现内源性环状RNA(circRNA)在所有人体组织中广泛表达,因此越来越关注于表征它们在疾病中的相关性和功能。大多数研究都集中在circRNA在实体瘤中的作用,其中circRNA被描述为致癌基因(例如,头颈部鳞状细胞癌中的circPVT1和结肠直肠癌,食管鳞状细胞癌细胞癌和肝细胞癌中的ciRS-7(CDR1as))或肿瘤抑制因子(例如胶质母细胞瘤中的circMARCA5和circ-SHPRH)。其他circRNA在实体瘤中的功能可能是细胞特异性的;例如,circHIPK3被认为在结直肠癌中是致癌基因,在膀胱癌中被认为是肿瘤抑制因子。而且,因为circRNA的表达水平总是与与临床和病理特征相关,因此这些RNA具有作为诊断、预后和预测的生物标志物的潜力。此外,circRNA的高稳定性允许它们在体液中非侵入地被检测,例如检测乳腺癌患者血浆中的circCNOT2和结直肠癌患者的血清外泌体中的circ-KLDHC。
circRNA在其他人类疾病中的表现较差,但在糖尿病,心血管疾病,慢性炎症性疾病和神经系统疾病的研究中出现了有趣的结果。尤其是在糖尿病中,ciRS-7和circHIPK3通过作为miR-7(cirs-7)、miR-124-3p、miR-338-3p的microRNA海绵,促进胰岛素的分泌并改善β细胞功能。在人类细胞中,circANRIL通过调节核糖体的生物发生、核仁应激,调节血管组织细胞的凋亡和增殖来预防动脉粥样硬化。另一个很重要的circRNA——心脏相关circRNA(HRCR),它在小鼠模型中预防病理性肥大和心力衰竭。另外,circRNA可能参与系统性红斑狼疮、牛皮廯和神经系统疾病,包括帕金森和阿尔兹海默症。最后宿主circRNA(host circRNA)可作为一种抗病毒的防御机制。例如,一个基因RELL1产生的一个circRNA(hsa_circ_0001400),在用卡波西肉瘤疱疹病毒感染原代内皮细胞时上调并在转录后抑制病毒基因表达而不影响病毒基因组的拷贝数。
circRNA的生物发生和特性
虽然反向剪接被视为选择性剪接的一种,但是它与线性选择性剪接的分子机制是不同的;然而,circRNA的生物发生的机制仍然相当难以捉摸。
cirRNA的生物发生
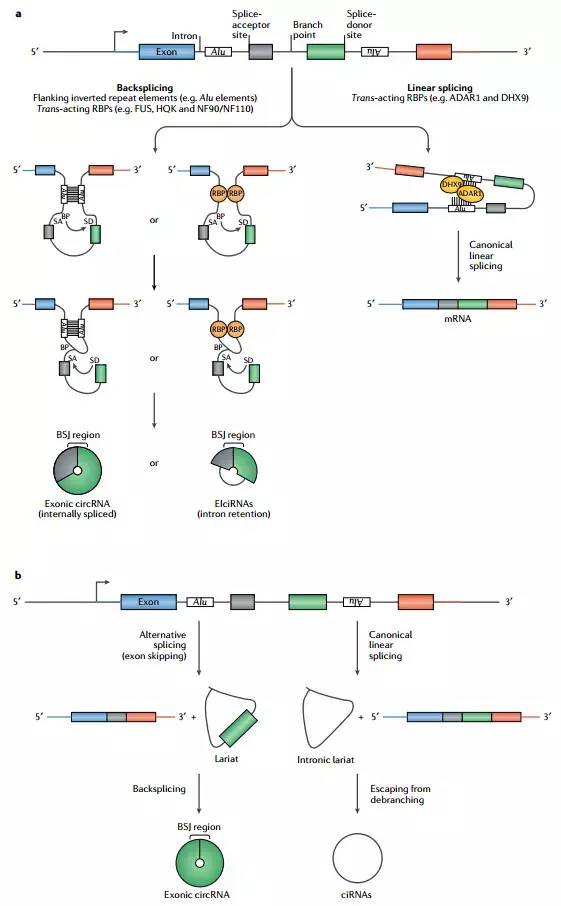
circRNA源于经典的剪切位点,在circRNA表达载体中的突变分析,以及用剪接抑制剂isoginkgetin处理HeLa细胞,阻断剪接体装配,都表明circRNA生物发生依赖于经典的剪接机制。相比之下,在黑腹果蝇细胞中的工作表明,通过耗尽U2 snRNP的成分来抑制剪接体显着增加了环状RNA与线性RNA的比例。这些数据显示,当mRNA前体加工事件变慢,新生的RNA会被导向另外一条路——促进反向剪接。这一概念得到了黑腹果蝇的另一项研究的支持,该研究表明,剪接因子的消耗增加了circRNA的水平; 当多个因子耗尽时观察到加性效应,每个剪接因子可能在circRNA的形成中起非冗余作用。反向剪接的主要假设是在下游剪接供体位点和上游剪接受体位点侧翼的内含子序列的环化,使位点得以接近。这种环化可以通过位于上游和下游内含子中的反向重复元件(例如Alu)之间的碱基配对介导,或通过结合到侧翼内含子特定motif的RNA结合蛋白(RBP)的二聚化介导(例如Protein quaking(HQK:QKI基因编码)或者RNA结合蛋白FUS)。然而,在黑腹果蝇中的工作表明,许多circRNA的生物发生受到顺势作用元件和反式作用剪接因子的共同影响,包括异核糖核蛋白(hnRNP)和SR蛋白质(即,含有丝氨酸、精氨酸残基的长重复序列的蛋白质)。
有趣的是,双链RNA(dsRNA) - 特异性腺苷脱氨酶(ADAR)酶(通过在内源性dsRNA上将腺苷修改为肌苷,来阻止先天免疫系统的激活)和ATP依赖的RNA解旋酶A(也被称为DHX9)抑制了依赖于反向重复之间碱基配对的circRNA的生物发生。具体来说就是,腺苷至肌苷的碱基编辑和dsRNA螺旋结构的结旋阻止了内含子序列的环化(FIG. 1a)。相比之下,NF90和NF110,他们都是白细胞介素增强子结合因子3基因(ILF3)的蛋白质产物,在此称为NF90 / NF110,参与宿主抗病毒机制,还可以通过稳定内含子RNA对促进circRNA的产生。
另外,外显子跳跃期间形成套索(可替换的外显子从mRNA中剪接出来,并最终包含在切除的套索内),当套索被反向剪切时,可导致circRNA的形成。最后,未被套索脱支酶水解的内含子套索会形成ciRNA(FIG. 1b)。
许多circRNA中涉及反向剪接的外显子倾向于有很长的内含子侧翼,这些circRNA一般来自具有高活性启动子的基因。另外,组蛋白和gene body区域上表观遗传的改变影响可变剪接,也可能会对circRNA和生物发生有直接影响。这一点还没有被系统地研究,但是最近一项最近的研究观察到DNMT3B(它编码DNA甲基转移酶,主要甲基化gene body区域)的敲降,使circRNA表达发生改变,这种改变与对应线性宿主基因表达无关。circRNAs上调和下调,表明基因体甲基化在circRNA生物发生中的作用依赖于遗传背景。另外,circRNA可以直接影响它们的宿主基因启动子区域的表观遗传状态,例如在乳腺癌细胞的致癌基因Friend leukaemia integration 1 transcription factor(FLI1编码)。这个致癌基因产生FLI1 extronic circRNA(FECR1),这个circRNA通过募集甲基胞嘧啶双加氧酶TET1诱导顺式CpG位点的去甲基化,TET1是一种诱导活性DNA去甲基化的Fe(II)/ 2-氧戊二酸依赖性双加氧酶。最后,已经有证据表明,产生circRNA的基因的平均转录延伸率高于产生非circRNA的基因。
Alu elements
最丰富的灵长类特异性DNA转座因子,高度重复,由约300个碱基组成。
套索形成 Lariat formation
当内含子的5'末端被去除时,形成的剪接中间体与具有2',5'-磷酸二酯键的腺苷分支点连接,产生套索形分子
脱支 Debranching
由DBR1编码的套索脱支酶,水解内含子套索中的2',5'-磷酸二酯键。这种水解将内含子套索转变成线性化的内含子,随后降解
circRNA的特性
在circRNA在生成后,除了含有内含子的circRNA,多大多数circRNA被输出到细胞质中。通过ATP依赖性RNA解旋酶DDX39A(也称为核RNA解旋酶URH49或URH49)和剪接体RNA解旋酶DDX39B(也称为DEAD盒蛋白UAP56或UAP56)以体积依赖性方式将circRNA从细胞核输出至细胞质。在人类细胞中,UAP56输出>1200nt的长circRNA,而URH49输出<400nt的短circRNA;然而,不同物种对于从细胞核转移到细胞质的cricRNA的长度可能要求不同。
circRNAs是特别稳定的分子,它们的转换的机制最近才开始被阐明。初步数据表明含有RNA修饰N6-甲基腺苷(m6A)的circRNA受到核糖核酸酶P(RNase P) - 多药耐药相关蛋白1(MRP)复合物的核糖核酸内切,其依赖于含有YTH结构域的家族蛋白2(YTHDF2)和热响应蛋白(HRSP12),并且在病毒感染时,环化RNA被RNase L全面降解。在转换的另一个例子中,microRNA(miRNA)miR-671与ciRS-7(也称为CDR1AS)中的高度互补的miRNA结合位点结合,以通过蛋白质Argonaute 2(AGO2)触发其切割——Argonaute蛋白在RNA干扰(RNAi)中起作用。这种切割可以通过miR-7增强,miR-7将miR-671沉默复合物募集到ciRS-7或通过尚未定义的机制将其保留在那里。使用人细胞系的研究表明,作为一种可能的清除机制,circRNA也可能被活跃地输出。确实,几项研究已经观察到,包括ciRS-7和circHIPK3,在细胞外囊泡中富含circRNA,但是还不清楚的是这是否会显著降低细胞内的circRNA水平。有趣的是,较小的circRNA更活跃地选择囊泡介导的输出,并且ciRS-7可以在细胞外囊泡中保持其环状性质并且在受体细胞中释放时发挥作用,表明这可能是一种重要的细胞间通信。
Fig. 1|circRNA的生物发生. a|外显子(彩色条带)的线性剪接和反向剪接之间的竞争发生在大多数人类基因的转录过程中。长侧翼内含子,反向重复元件(如Alu元件)和反式作用RNA结合蛋白(RBPs;例如,RNA结合蛋白FUS,quaking蛋白(HQK)和NF90和NF110,两者都是蛋白质产物。白细胞介素增强子结合因子3基因)有利于后突(左)。具体地,反向重复元件之间的碱基配对或RBP的二聚化使下游剪接供体位点(SD)与上游剪接受体位点(SA)紧紧相邻。这种关联可能导致由经典剪接装置(未示出)促进的反向剪接发生。在反向剪接期间,上游分支点(BP)攻击下游SD位点,其随后攻击上游SA位点以导致外显子 - 内含子circRNA(EIcircRNA)或外显子circRNA(即内部内含子被剪接去除)的形成。经典线性剪接(右)受短侧翼内含子包围的外显子和由反式作用RBP双链RNA特异性腺苷脱氨酶(ADAR1)和ATP依赖性RNA解旋酶A(DHX9)结合的内含子的青睐。这些RBP破坏了反向重复元件之间的碱基配对,允许剪接装置产生线性mRNA. b|circRNA也可以由称为套索前体的剪接中间体产生,所述中间体由线性剪接期间的外显子跳跃事件(左)或从经典线性剪接的脱支步骤逃逸的内含子套索前体产生(右)。BSJ,backsplice junction; circRNA,环状RNA; ciRNA,环状内含子RNA.
发现和分析circRNA
尽管发现了超过100,000个独特的人类circRNA,但与转录组的其他组分相比,这些分子的研究尚未得到充分研究。此外,大多数公开可用的RNA-seq数据集基于通过其poly(A)尾分离的RNA,因为缺少poly(A)尾,所以极少含有circRNA。因此,与通过用poly(A)尾部过滤来耗尽RNA样品中核糖体RNA(rRNA)的标准RNA-seq不同,circRNA的全基因组分析必须使用替代方法来耗尽rRNA(例如,Ribo-Zero 技术捕获rRNA)。全基因组和基因座特异性的circRNA检测方法通常可识别circRNA中独特的反向剪接点(Backsplice junction (BSJ)
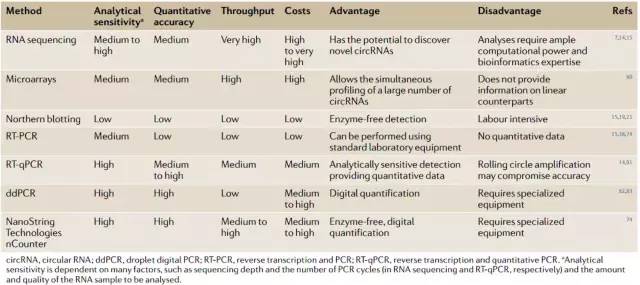
region)区域,但它们无法检测内部的剪接模式。用于检测circRNA的大多数方法包括逆转录(RT)步骤,其可引起由于模板转换导致的错误的circRNA预测。此外,随后的PCR步骤会使结果产生偏差,因为一些circRNA比其他的更有效地扩增(TABLE 1)。另外,外显子重复(就是线性mRNA中的外显子多聚体)和反式剪接事件会发生,并且可能会导致错误的circRNA预测。因此,转录本的环状性质总是用核糖核酸酶R验证,它特异性地降解线性RNA。然而,然而,较长的circRNA会对核糖核酸酶R消化敏感,并且一些线性RNA对其具有抗性,可能是由于它们的二级结构。先前已经有对于检测和定量circRNA方法的综述,补充了以下讨论; 然而,我们还描述了该领域最近的方法学发展。
反向剪接区域 Backsplice junction(BSJ) region
在一级序列水平,环状RNA(circRNA)与相应线性RNA唯一不同的区域。它通过产生circRNA的反向剪接事件产生,并且由经典的5'剪接位点序列与上游3'剪接位点序列连接组成。
circRNA全基因组分析
对耗尽rRNA的总RNA进行RNA-seq是发现新型circRNA的首选方法,并且它被用于所有早期circRNA分析研究。这个方法的优势是可以同时提供编码和非编码RNA表达数据。然而,circRNA的可靠定量通常对测序深度要求高,这取决于研究组织中circRNA的表达水平。我们建议进行至少100-bp长度的测序以获得足够的read长度,以便能够基于read-spanning的BSJ对circRNA进行可靠的预测。用于鉴定circRNA的新生物信息学算法正在不断发展,现在有许许多多的生物信息学算法。CIRI2算法可能是最好的de novo stand-alone算法,但是我们建议使用两种独立的算法以确保能正确地注释BSJ。实际上,外显子边界处的序列同源性和简并序列可能干扰circRNA的预测。此外,比对软件(例如,Bowtie2或STAR)和算法采用的相关严格性要求各不相同,并且它们的假阳性率显著不同,强调算法检测到的circRNA需要进一步验证。因此,在没有金标准算法的情况下,使用一个以上的circRNA预测算法可以最小化误报的数量。
Microarray是用于鉴定circRNA的RNA-seq的可行替代方案,因为它们的使用需要较少的生物信息学专业知识。第一种针对人、小鼠和大鼠circRNA商业化的microarray由Arraystar Inc提供。这个array包含>10,000个从重要出版物中选择的circRNA,工作流程包括RNase R处理以降解线性RNA。尽管这种处理提高了测定的分析灵敏度,但是当两种类型的RNA可以由同一基因产生的情况下,它排除了线性与circRNA比率的评估。
circRNA位点特异性分析
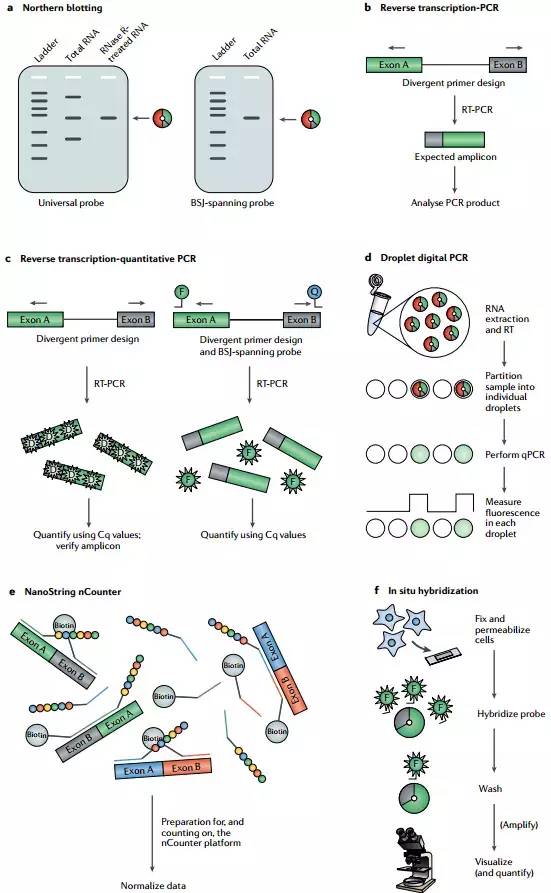
circRNA的基因座特异性检测,依赖于BSJ的基因组位置的知识,可用于验证来自全基因组实验的数据或研究先前表征的circRNA。许多常用的分子生物学技术已经被用于检测circRNA,并且每种技术在该领域中具有特定的优点和缺点(TABLE 1)。Northern blotting是验证cricRNA的金标准,因为它不会包含RT或者扩增步骤。相反,该技术使用与待验证的BSJ重叠的探针或通用探针,其针对来自相同基因的环状和线性转录物以及RNase R消化(FIG . 2a)。然而,Northern blotting需要大量RNA,耗时且通常使用放射性标记的探针。因此,使用不同BSJ侧翼的引物来检测circRNA的RT-PCR,通常优先用于circRNA的验证(FIG. 2b)。
鉴定差异表达的circRNA的研究需要定量数据,其通常通过RT和定量PCR(RT-qPCR)测定产生,也使用BSJ侧翼的不同引物。使用双链DNA插入荧光染料或覆盖BSJ的荧光标记探针实时监测PCR产物的扩增(FIG. 2c)。由于目前还没有商业化用于检测和定量circRNA的可用的RT-qPCR测定,因此需要大量努力来设计、优化和验证这些测定。虽然应该遵循一般的RT-qPCR指南,但是额外的挑战,例如在RT期间通过滚环扩增形成多聚体,可能妨碍精确的RT-qPCR介导的circRNA定量。然而,由于ddPCR使用正负液滴的比率确定circRNA的绝对浓度,因此认为多聚体不会影响使用液滴数字PCR(ddPCR)对circRNA的定量分析(FIG. 2d)。因此,ddPCR在定量circRNA方面可能比RT-qPCR更准确,并且特别适用于检测如血浆这种具有挑战性的样品中的circRNA,这些样品中的circRNA的量可以被限定。NanoString Technologies的nCounter平台基于通过自动荧光显微镜进行的单分子数字计数,可在需要高通量时用于量化circRNA。生物素化的捕获探针和携带荧光barcode的报告探针(均为50个核苷酸)靶向BSJ,以确保特异性(FIG. 2e)。每个barcode由一串荧光团组成,每个转录本都是独特的,这意味着在一个实验中可以量化多达800个转录本。将探针添加到RNA样品中并使其杂交过夜,形成特异性探针 - 靶标复合物。然后,由于生物素化的捕获探针,这些复合物可以固定在链霉抗生物素蛋白包被的表面上,并且可以洗掉过量的探针和未结合的RNA。最后,通过施加电流使复合物线性化,并且通过高分辨率电荷耦合器件(CCD)照相机通过显微镜物镜计数报告探针上的各个barcode。该方法不含酶,因此不会产生与PCR扩增和cDNA合成相关的偏倚和假象。它适用于从福尔马林固定的石蜡包埋样品中提取的RNA,并有可能成为circRNA检测的新金标准。然而,量化circRNA的panel需要设计定制,因为它们还未商业化。
circRNA可视化
在细胞中对circRNA可视化对理解它们的生物学内容很重要。使用与碱性磷酸酶,荧光染料或抗原(如洋地黄毒苷)偶联的寡核苷酸探针的原位杂交(ISH)可用于细胞中可视化circRNA,用来固定和透化细胞中目的circRNA。为了检测具有线性对应物的circRNA,探针应该跨越BSJ。为了优化设置,可以用蛋白酶K(以消化蛋白质)和RNase R处理固定的样品,并且可以在对照样品中使用小干扰RNA(siRNA)介导的circRNA或mRNA7的敲低来估计在测试样品中非特异性结合。许多ISH方法需要使用多个探针覆盖靶标的大部分;由于BSJ区域是唯一独特的区域,因此在分析circRNA时排除了这一要求。但是,BaseScope等技术可以放大信号,因此一对50bp的探针就足够了。这种方法已被用于检测可变剪接事件和单核苷酸变异。另一种有吸引力的成像和跟踪特定circRNAs的方法可能是使用催化dead Cas13a(以前称为C2c2)连在荧光蛋白上(如增强型GFP( EGFP))。dead Cas13a保留了对靶RNA的高亲和力,因此可以用作基于guide RNA的可编程RBP,类似于CRISPR-Cas9用于基因组工程。然而,该方法将限于BSJ满足设计guide RNA需要的序列条件的circRNA。
Table 1|检测和定量circRNAs表达的方法.
Fig. 2|用于检测和量化circRNAs表达的方法.a | Northern印迹通常与核糖核酸酶(RNase)R处理组合使用以鉴定对应于目标环状RNA(circRNA)的条带。探针可以靶向基因的环状和线性转录物(左)或特异性识别反向剪接(BSJ;右). b |为了检测circRNA,逆转录(RT)-PCR利用不同的引物对,其仅在PCR期间扩增circRNA。通过凝胶电泳和/或测序分析PCR产物. c | RT和定量PCR(RT-qPCR)也利用不同的引物对来定量circRNA。检测可以基于双链DNA嵌入荧光染料(D)(左)或基于探针(用荧光团(F)和猝灭剂(Q)分子标记,跨越BSJ)(右)。在两种情况下,使用循环量化(Cq)值来量化circRNA水平,其表示样品的反应曲线与阈值线相交的PCR循环数。当使用嵌入染料时,应通过熔解分析或凝胶电泳确认扩增子的特性. d |液滴数字PCR可用于circRNA的绝对定量,并且基于液滴中单个分子的qPCR,其随后基于荧光信号进行分析并评分为阳性或阴性. e |在NanoString Technologies nCounter测定中,可以基于它们与生物素化捕获探针和报告探针的杂交同时定量多个circRNA,所述报告探针携带每个circRNA的独特荧光barcode。探针跨越目的circRNA的BSJ,并且当以相反方向结合相应的线性转录物时不产生信号。过夜杂交之后,使用链霉抗生物素蛋白包被的表面洗涤,固定生物素化的捕获探针,比对探针 - 靶标复合物和计数与nCounter平台上的探针杂交的circRNA. f |原位杂交可以提供一个或几个circRNA的半定量数据,以及其他信息,例如其亚细胞定位。
circRNA的生物学功能
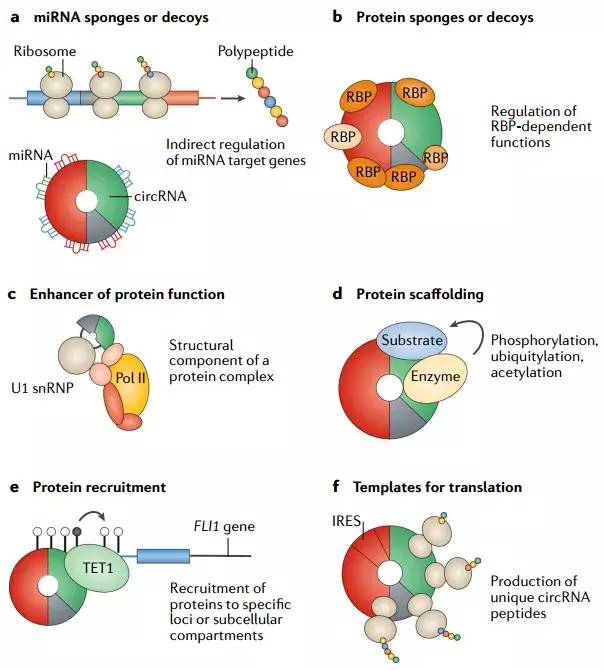
密码子的第三个位置 - 由于遗传密码的冗余而通常保守程度不高 - 在一些circRNA中比在不是circRNA的一部分的外显子中更保守,这表明circRNA具有重要的非编码功能,反映了它们稳定性高。然而,生物学功能仅针对迄今鉴定的一小部circRNA进行了研究,其中大多数已被提出作为miRNA海绵(FIG. 3a)。此外,交联免疫沉淀数据集表明,circRNA与许多不同RBP相互作用,作为蛋白质海绵(FIG. 3b),增强蛋白质功能(FIG. 3c),充当支架来介导特定酶和底物之间的复合物形成(FIG. 3d),并将蛋白质募集到特定位置(FIG. 3e)。此外,尽管绝大多数circRNA被认为是非编码的,但是一部分circRNA在特定条件下经历了不依赖于帽的翻译。关键circRNA的作用机制和提出的生物学功能列于TABLE 2中并在下面讨论。
Fig. 3| circRnA功能的一般机制. a|环状RNA(circRNA)可以作为microRNA(miRNA)海绵或诱饵起作用,保护靶mRNA(如上图所示)免受miRNA依赖性降解。因此,如图所示,靶RNA更活跃地被核糖体翻译和结合. b |含有RNA结合蛋白(RBP)结合基序的circRNA可以作为这些蛋白质的海绵或诱饵,并间接调节它们的功能. c |如含有U1小核核糖核蛋白(snRNP)和其他蛋白质的RNA聚合酶II(Pol II)复合物所示,circRNA可以与特定蛋白质相互作用并增强其功能. d | 一些circRNAs已被证明可作为蛋白质支架起作用,促进酶(例如,磷酸酶,乙酰化酶和泛素连接酶)及其底物的共定位,从而影响反应动力学. e | circRNA还可以将特定蛋白质募集到某些基因座或亚细胞区室,如本文所示的circRNA FLI1外显子circrRNA(FECR1),其将甲基胞嘧啶双加氧酶TET1募集到其自身宿主基因的启动子区域. f | 最后,具有内部核糖体进入位点(IRES)元件和AUG位点的circRNA可以在某些情况下翻译,产生独特的肽。改编自(Kristensen. 2018 Oncogene. ) CC BY 4.0(https://creativecommons.org/licenses/by/4.0/).
单个circRNA作为miRNA海绵
当将miRNA海绵功能分给circRNA时,考虑circRNA的miRNA结合位点和miRNA的mRNA靶位点之间的化学计量关系很重要,因为含有许多竞争结合位点的高度丰富的circRNA更可能具有竞争的内源RNA功能。ciRS-7可能是表征最好的circRNA,含有miR-7的超过70个保守结合位点,在许多组织中高度、稳定表达,尤其是在大脑中。因此,它有潜力去调节miR-7靶基因的表达。因为ciRS-7在神经元组织中的丰度尤其高,所有它可能涉及神经元功能和分化,但是ciRS-7对miR-7是抑制还是保护,可能取决与具体的细胞环境。确实,从小鼠基因组中去除ciRS-7位点导致miR-7下调,而其他的研究发现ciRS-7表达与miR-7表达是负相关的。有趣的是,包括miR-7靶基因Fos在内的即刻早期基因在ciRS-7基因敲除小鼠中被上调,这些小鼠表现出与神经精神疾病相关的行为表型。虽然许多其他circRNAs,包括circHIPK3和circBIRC6,随后被证明具有miRNA海绵特性,但与ciRS-7不同,大多数circRNA不包含比偶然预期更多的miRNA结合位点。circBIRC6和circCORO1C作为miRNA海绵,抑制了miRNA介导对多能性基因NANOG、OCT4(也被称为POU5F1)和SOX2的抑制作用,促进了人类胚胎干细胞多能性。而其他circRNA,如circZNF91,会在表皮干细胞分化过程中被诱导。基于其序列,在ciRS-7之后,circZNF91是下一个最有可能作为miRNA海绵的circRNA,它包含24个miR-23b-3p的靶位点,其在角质形成细胞分化中具有重要作用。
circRNAs,例如circCCDC66,circHIPK3,circPVT1和ciRS-7,也可能作为癌症中的miRNA海绵。值得注意的是,circRNA可以通过作为miRNA海绵作用于多种不同的miRNA而不是通过包含一种特定miRNA的多个位点而具有肿瘤抑制或致癌功能。例如,致癌circCCDC66含有靶向致癌基因的几种miRNA的结合位点,包括靶向MYC致癌基因的miR-33b和miR-93。最后,已有假设提出,分化细胞中较高的circRNA总体水平可以协同作用以结合大量miRNA,尽管这尚未通过实验验证。
单个circRNA通过与蛋白质的相互作用发挥功能
作为蛋白质海绵起作用的circRNA的第一个例子来自对黑腹果蝇中编码盲肌蛋白 1(mbl)的剪接因子蛋白基因的研究。mbl是人类盲肌样蛋白 1(由MBNL1编码)的同源物。该基因在黑腹果蝇和人类中产生circRNA,circMbl,其分别包含mbl和MBNL1的结合位点。此外,位于circMb1侧翼的内含子具有许多mbl(或MBNL1)结合位点,mbl(或MBNL1)的结合促进新生RNA的环化以促进circMb1生物发生。因此,可能存在自动调节电路,其中过量的mb1或MBNL1通过促进circRNA生物发生而减少其自身mRNA的产生,并且circRNA通过束缚mb1或MBNL1促进基因的线性剪接。
其他circRNA,例如circPABPN1和circANRIL,也通过与靶蛋白相互作用起作用。circPABPN1通过螯合人宫颈癌HeLa细胞中的RBP Hu抗原R(HUR)来抑制核多聚(A)结合蛋白1(PABPN1)mRNA的翻译,而circANRIL通过与pescadillo同源物1(PES1)结合而损伤rRNA前体加工和核糖体生物发生。PES1是人血管平滑肌细胞和巨噬细胞中一种重要的60S核糖前体组装因子。因此,circANRIL诱导核仁应激和p53的激活,这可能通过从动脉粥样硬化斑块中去除过度增殖细胞来防止动脉粥硬化形成。
另一项研究在小鼠中发现了一种来自D430042O09Rik基因的circRNA,该基因可保护长期造血干细胞免于衰竭(失去自我更新能力),而这种衰竭是由环形GMP-AMP(cGAMP)合成酶(cGAS)介导。具体地来说,cGAMP是在cGAS与自身DNA结合时产生的。cGAMP激活衔接分子STING,刺激I型干扰素的产生,导致造血干细胞退出G0期并进入活跃的细胞周期直至它们耗尽。这个circRNA被命名为cGAS(cia-cGAS)的circRNA拮抗剂,因为它直接结合核cGAS以防止其结合自身DNA。
一些circRNA,例如circ-Amotl1和circFoxo3,作为蛋白质支架起作用以促进酶及其底物的共定位。circAmotl1物理结合3磷酸肌醇依赖性蛋白激酶1(PDK1)和AKT1(也称为蛋白激酶B),并促进PDK1依赖的AKT1磷酸化; 随后AKT1转运至细胞核,在小鼠模型中显示其具有心脏保护作用circ-Foxo3的功能之一是它促进MDM2介导的突变型p53的泛素化,并将其靶向蛋白酶体介导的降解。
最后,circRNA可能募集特定的蛋白质某些细胞位置,如circRNA FECR1,它将TET1募集到启动子区域FLI1(FECR1的宿主基因),导致CpG位点的去甲基化,使转录变得活跃。
长期造血干细胞 Long-term haematopoietic stem cells
造血干细胞由特定的表面标记物定义,可以无限自我更新并分化为血液和免疫系统内的所有细胞类型。
Table 2 | 重要circRNA的作用机制和生物学功能
多个circRNA与蛋白质相互作用的协同作用
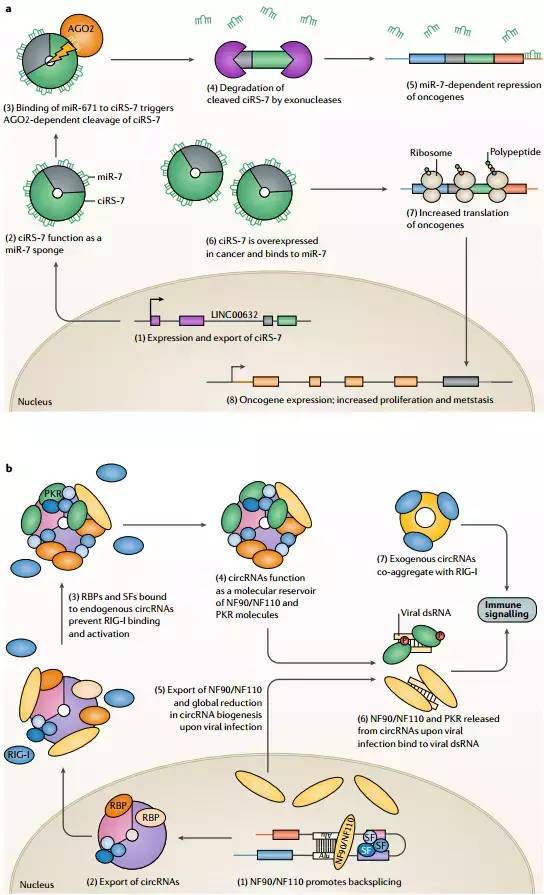
特定蛋白质与细胞质中多个circRNA的协同结合可以产生蛋白质的分子储库,其对细胞外刺激作出迅速反应。这种情况可用于在病毒感染后实现迅速的免疫应答,例如抗病毒蛋白NF90 / NF110,其优先结合circRNA而不是其在细胞质中的线性对应物; 由于circRNA的高稳定性,这种结合可能产生NF90 / NF110的分子储库。类似地,形成16-26bp的分子内不完全RNA双链体的许多不同的内源性circRNA可以结合具有直接抗病毒活性的核酸受体PKR。结合的PKR的circRNA被细胞质内切核糖核酸酶RNase L切割,其由寡腺苷酸合成酶(OAS)在与病毒dsRNA结合时产生的2',5'-连接的寡核苷酸活化。随后,PKR分子被释放,磷酸化和活化。此外,病毒感染可以触发内源性circRNA的协调的全基因组调节。特别是,病毒感染后NF90 / NF110和活化的RNase L的核输出增加导致circRNA的丰度显着降低(FIG . 4)。
有趣的是,外源circRNA可以通过激活模式识别受体RIG-I来刺激哺乳动物细胞中的免疫信号,而内源性circRNA则不会。细胞区分内源和外源circRNA的能力取决于位于circRNA侧翼和剪接机制上的内含子序列,而不依赖于circRNA的一级序列。因此,细胞感知多种外来circRNA,例如丁型肝炎病毒和类病毒的基因组,而不管它们的一级序列,而不响应内源性circRNA。具体而言,包括剪接因子在内的RBP可能通过掩盖其中的RIG-I识别元件将内源性circRNA标记为“自身”(FIG. 4)。然而,这些结果与最近的工作相冲突,最近研究显示外源性circRNA不会激活细胞RNA传感器,如Toll样受体和RIG-I。这项研究的作者表明,可能在之前的研究中,使用RNase R生成的circRNA制剂中的杂质已经激活了RNA传感器,因为即使是少量的污染性线性dsRNA,其中一些可能含有三磷酸化的dsRNA,也可以激发强烈的细胞免疫应答。
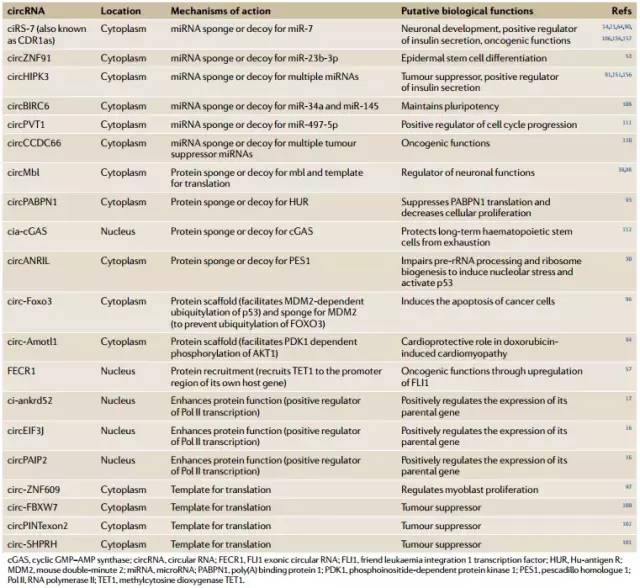
Fig. 4 | circRNA作为miRNA/蛋白质海绵. a | 环状RNA(circRNA)可在肿瘤发生过程中充当microRNA(miRNA)海绵。circRNA ciRS-7由长的非编码RNA LINC00632产生并输出到细胞质中(步骤1),其作为肿瘤抑制剂miRNA miR-7的海绵起作用(其具有> 70个保守的miR-7结合位点) ) (第2步)。miR-671与ciRS-7的结合促进了AGO2对circRNA的切割(步骤3),导致ciRS-7的降解和miR-7的释放(步骤4),然后miR-7自由地抑制其靶基因(步骤5)。ciRS-7在几种人类恶性肿瘤中过表达(步骤6),导致miR-7靶基因(如EGFR和RAF)的翻译增加(步骤7),激活MAPK信号传导途径并增加增殖性信号传导和转移(步骤8). b | 在没有病毒感染的情况下,circRNA可以作为蛋白质海绵。当细胞不含病毒时,NF90 / NF110通常通过稳定内含子RNA二级结构并从而反向剪接来促进circRNA生物发生(步骤1)。新合成的circRNA被输出到细胞质(步骤2)并与剪接因子(SF)和RNA结合蛋白(RBP)结合,阻止RIG-I模式识别受体与它们结合,而将它们标记为“自身”分子(第3步)。在细胞质内,circRNA还可以作为抗病毒蛋白NF90 / NF110和PKR的分子储库(步骤4)。病毒感染后,NF90 / NF110转运至细胞质;核NF90 / NF110的减少促进了circRNA生物发生的全面减少(步骤5),并且原与circRNA结合的NF90 / NF110和PKR被释放,并与病毒双链RNA(dsRNA)结合,以获得快速抗病毒免疫应答,这里涉及PKR的磷酸化(P)(步骤6)。最后,也可以通过RIG-I与病毒circRNA的结合来刺激免疫信号(步骤7)。
翻译的circRNA的功能
circRNA缺乏帽依赖性翻译的必需元件,例如5'帽和poly(A)尾。然而,如通过工程化的circRNA所证明的,circRNA的帽非依赖性翻译可以通过内部核糖体进入位点(IRES)或在5'非翻译区(UTR)中加入m6A RNA修饰后发生。尽管预计有数千种circRNA含有假定的开放阅读框(ORF)和上游IRES,迄今为止,只有少数内源性circRNA,例如circ-ZNF609,circMb1,circFBXW7,circPINTexon2和circ-SHPRH,已被证明可作为蛋白质模板。大多数circRNA衍生肽的功能相关性仍然未知。然而,由于circRNA衍生的肽通常是缺乏必需功能结构域的标准蛋白的截短形式,它们可能作为替代蛋白复合物的显性-阴性蛋白变体,诱饵或调节剂。
FBXW-185aa,PINT87aa和SHPRH-146aa(这些钛分别来自circ-FBXW7,circPINTexon2和circ-SHPRH)都被认为在人胶质母细胞瘤中起肿瘤抑制剂的作用。FBXW-185aa与去泛素化酶USP28竞争性地相互作用,其在正常条件下阻止FBXW7α诱导的癌蛋白MYC的降解 - 注意编码FBXW7α的同种型是FBXW7基因中最丰富的亚型。PINT87aa与RNA聚合酶II相关因子1同源物(PAF1)复合物结合,通过增加结合亲和力并确保PAF1复合物在细胞核中来增强其与靶基因启动子的相互作用。PAF1复合物帮助Pol II募集到靶向启动子并调节转录延伸。与PINT87aa结合后,PAF1复合物增加其与靶启动子的结合亲和力,导致mRNA延伸降低并阻止癌基因如CPEB1,SOX-2和MYC102的表达。最后,SHPRH-146aa可能作为诱饵起作用,保护全长E3泛素蛋白连接酶SHPRH蛋白免受DTL的泛素化和随后的降解。SHPRH通过靶向癌蛋白增殖细胞核抗原(PCNA)进行降解而起到肿瘤抑制剂的作用。
circRNA衍生的肽也可以在与规范蛋白质不同的条件下表达,例如在细胞应激时,或在与经典蛋白质不同的细胞区室中起作用,因此在细胞内充当受调节的蛋白质产物。实际上,circ-ZNF609和含有m6A的circRNA的翻译是在人类细胞中热休克时诱导的,而circ-Mbl-肽是在黑腹果蝇饥饿后产生和/或稳定的。
模式识别受体 Pattern recognition receptor
识别病原体典型分子的宿主受体。在识别病原体相关模式后,先天免疫系统被激活。
内部核糖体进入位点 Internal ribosome entry sites
结构RNA元件,可以启动与5'帽无关的翻译
确定circRNA功能的方法
研究试图通过实验操纵它们的表达水平和表征它们的相互作用分子来阐明circRNA的功能。然而,circRNA的功能表征并不简单,因为大多数circRNA具有可干扰数据解释的线性对应物; 相反,丰富的circRNA可能干扰来自相同基因座的线性转录物的研究。例如,研究显示lncRNA RMST调节多能性和神经发生,在不知不觉中敲除了线性和环状RMST转录物; 随后的研究表明,RMST的主要形式是循环的。在这里,我们讨论可用于表征circRNA的方法(FIG. 5)。
表征circRNA-miRNA相互作用的方法
证明circRNA作为miRNA海绵起作用是很具有挑战性的;在circRNA中存在推定的miRNA结合位点不一定表明circRNA抑制这些miRNA。实际上,应考虑潜在海绵中和靶mRNA中miRNA结合位点之间的化学计量关系;靶mRNA抑制的显着降低可能需要circRNA具有许多竞争性miRNA结合位点。优选使用Argonaute交联和免疫沉淀或Argonaute免疫沉淀收集的实验数据来证明circRNA具有真正的miRNA海绵功能。然而,尽管使用这些技术得到的数据提供了Ago蛋白和RNA之间关联的高可信度,但它们并不区分circRNA和线性RNA。因此,circRNA应使用circRNA特异性方法定量,例如具有不同引物设计的RT-qPCR。然而,Ago和目的circRNA和miRNA的免疫共沉淀并不是无可争辩的证据,即circRNA可作为miRNA海绵; circRNA-Ago关联必须对miRNA水平的扰动敏感,并且内源靶标的表达水平和报告分析的活性应分别通过circRNA的过表达和消耗而增加和减少(FIG 5a)。
表征circRNA-蛋白质相互作用的方法
评估circRNA-蛋白质相互作用的方法基于circRNA(以RNA为中心)或蛋白质(以蛋白质为中心)的分离,然后分析分离的组分的相互作用分子。由于这些技术及其相关的挑战已在其他地方详细讨论过,因此我们关注与circRNA-蛋白质相互作用研究相关的具体问题。
在以RNA为中心的方法中,使用靶向目的circRNA的反义探针,诸如RNA反义纯化,RBP的综合鉴定或RNA靶标的捕获杂交分析等技术,从细胞裂解物中提取circRNA和相关蛋白。由于circRNA的唯一独特区域是BSJ,因此必须确认分离的circRNA的身份。如前所述,单个BSJ-spanning探针可以提取目的circRNA。或者,如果细胞裂解物用RNase R或用poly(A)选择试剂盒处理以在提取前除去线性RNA,则可以使用在任何位置靶向circRNA的探针。可以使用低通量方法(例如蛋白质印迹法)或高通量方法(例如质谱法)分析circRNA相关蛋白(FIG. 5b)。
为了鉴定与目的蛋白质相关的circRNA,可在RNA的免疫共沉淀中使用针对该蛋白质的抗体。然后可以通过基因座特异性方法或通过高通量方法如RNA-seq分析与蛋白质相互作用的circRNA。为了使用基于交联免疫沉淀(CLIP)的方法在circRNA上绘制精确的蛋白质结合位点,必须在免疫沉淀之前去除线性RNA。
Argonaute交联和免疫沉淀 Argonaute-crosslinking and immunoprecipitation
一种鉴定和定位与Ago蛋白结合的microRNA和与其相关的靶转录物的方法。
研究circRNA翻译的方法
大多数circRNA由蛋白质编码基因产生,并且circRNA中的推定ORF通常与相应mRNA序列中的经典ORF重叠。因此,只有BSJ下游和推定的终止密码子之前的序列可用于确定蛋白质是否来自线性或环状转录物(图5c)。此外,circRNA通常以低于相应mRNA的水平表达,使得确定circRNA是否被翻译具有挑战性。为了评估是否翻译了circRNA,可以使用荧光素酶报告基因(图5c)或通过分析m6A甲基化来确定ORF和功能性IRES样元件的存在。另外,跨越BSJ的circRNA特异性肽应优先选用质谱法检测。无论是在小基因设置中还是在内源性地使用CRISPR-Cas9,将蛋白标签插入circRNA ORF的推定终止密码子的上游(图5c)也是有用的。如果没有针对circRNA特异性部分肽的抗体可用,则该标签可用于通过蛋白质印迹研究该肽(图5c)。该标签还可分别用于RNA-seq或质谱法鉴定可能与circRNA肽相互作用的RNA或蛋白质,也可用于免疫荧光评估circRNA肽的亚细胞定位。最后,可以使用多核糖体谱或核糖体足迹提供进一步证据表明circRNA被翻译。
为了研究circRNA衍生肽的生物学相关性,环状转录物可以异位和内源过表达,或进行敲低或敲除(见下文),并评估对基因表达谱和细胞表型的影响。
多聚核糖体图谱分析技术 polysome profiling
一种基于蔗糖梯度分离非翻译和翻译的RNA转录本来研究翻译的技术; 翻译的RNA转录物与多核糖体有关。核糖体足迹谱技术 ribosome footprinting
一种通过核糖体保护RNA片段的高通量测序来测量翻译的技术,它可以确定核糖体在密码子分辨率下的位置。
RNAi敲降circRNA
功能丧失研究是理解任何circRNA的功能和生物相关性的关键,它们通常涉及RNAi。靶向circRNA的BSJ的siRNA通常对于环状转录物是有效且特异的,尽管使用化学修饰的siRNA(例如锁核酸和非锁核酸)可以提高敲降效率或限制脱靶效应。此外,在针对BSJ时,设计空间受到限制;可能需要使用乘客禁用的siRNA。不幸的是,siRNA的应用依赖于高转染效率,并且这些RNA仅瞬时敲降其靶标。用表达短发夹RNA(shRNA)或AgoshRNA的载体转染细胞,具有较少的脱靶效应,可以使靶标更稳定的敲降。CRISPR-Cas系统,特别是那些使用核糖核酸酶Cas13a的系统,在RNA引导的转录物降解中也是有效的,但尚未用于敲除circRNA。
锁核酸 locked nucleic acids
修饰的RNA核苷酸,其中核糖部分用连接2'氧和4'碳的亚甲基桥修饰。相对于传统的DNA或RNA寡核苷酸,它对其互补核苷酸具有增加的亲和力
非锁核酸 unlocked nucleic acids
非环状RNA核苷酸,缺少传统RNA中发现的核糖部分的C2'-C3'键。相对于传统的DNA或RNA寡核苷酸,它对其互补核苷酸的亲和力降低
乘客缺陷siRNA Passenger disabled siRNA一种小的干扰RNA(siRNA),其中完整的反义链与片段化的正义链互补。这些siRNA被称为小的内部片段干扰RNA,通过仅允许反义链功能性加入RNA诱导的沉默复合物(RiSC)来消除脱靶效应。
AgoshRNAs短发夹RNA的特征在于相对短的碱基配对茎,这允许它们避免Dicer切割。相反,它们由Ago2的切割活性加工产生sgRNA,进而靶向特定RNA并降解RNA。因为不产生乘客链(passenger strand),所以具有较少的脱靶效应。
敲除circRNA
大多数circRNA来源于蛋白质编码宿主基因,这使得circRNA特异性敲除的产生变得复杂。如果已知对于circRNA生物发生重要的侧翼内含子基序,则从基因组中去除这些元件可以消除或减少circRNA表达而不改变宿主基因的稳态RNA水平。然而,该方法需要先前了解circRNA的生物发生以及仔细确认宿主基因表达未改变。
即使对于没有注释宿主基因的circRNA,例如ciRS-7,在敲除circRNA时也要小心。实际上,因为没有已知ciRS-7的线性宿主基因,所以通过去除产生circRNA的外显子产生ciRS-7敲除小鼠模型。然而,最近的分析鉴定了从与ciRS-7相同的基因座产生的线性RNA,并且显示该线性RNA的稳态水平在ciRS-7敲除模型中增加。该发现提出了ciRS-7敲除小鼠的表型是否是由于ciRS-7的丧失还是线性RNA的表达增加的问题。
过表达circRNA
还可以通过过表达目的circRNA来研究circRNA的功能和生物学相关性;可以表达整个基因或可以使用小基因设置,其中环化外显子(或外显子)侧接经典剪接位点和反向互补序列。互补序列可以是天然存在的重复元件,例如Alu元件,或者可以通过取上游内含子的区域(> 30个核苷酸)并以倒置方向将其插入环化外显子的下游来产生。另一种有利于从质粒表达circRNA转录物的方法是在侧翼内含子中加入特定RBP的结合结构域以促进环化。最后,可以通过基于转移RNA剪接机制的方法过表达circRNA。
为了产生过表达某种circRNA的稳定细胞系和动物模型,可以用完整或线性化的circRNA产生质粒转染或转导细胞,并使用抗生素筛选。然而,该方法通常导致随机插入circRNA表达基因座,可能干扰其他基因。对于所有异位circRNA过表达策略的另一个警告是,线性转录本和环状多联聚体通常是共同产生的;当circRNA与线性RNA和多聚体平行表达时,应该通过实验评估产生的线性和环状转录物的量并谨慎解释数据。
总结和未来展望
circRNA研究领域的最新进展揭示了circRNA生物发生和生物学的核心方面,但我们仍需要更多地了解这些分子在健康组织和疾病中的调节和功能。允许在特定细胞类型或亚克隆中,优先选择在单细胞水平上,确定空间和时间基因表达模式的方法将很有帮助。单细胞RNA-seq仅在两项研究中用于检测circRNA,但未来可能会更多地用于研究circRNA的生物学。另一项有前景的技术,名为Digital Spatial Profiling,基于NanoString Technologies的GeoMx Digital Spatial Profiling平台,可在福尔马林固定的石蜡包埋组织载玻片上,在用户定义的目的区域内实现蛋白质或mRNA的高度多重和空间分辨数字表征。在未来,我们期望对该技术进行调整以允许对circRNA进行定量。最后,Oxford Nanopore MinION技术提供了非常长的测序读数,因此可以解析内部剪接模式,已被用于测序circRNA扩增子,并可能在不久的将来适应全基因组circRNA测序。
circRNA研究领域为我们带来了许多令人惊讶的发现,这意味着circRNA在生物学和病理生物学中具有重要意义。已经通过RNA-seq鉴定了数千种在不同组织和疾病中的推定的circRNA,尽管其中绝大多数尚未通过其他技术验证或在功能上进行研究。本综述中描述的技术将有助于RNA-seq数据的有效验证,并有助于揭示circRNA生物学的新方面。





请问有没有原文呀~都下不到
10.1038/s41576-019-0158-7
这篇文章太难了,我看了好久还搞不太懂,今天快看完了结果阴差阳错看到你的翻译,哎,早点看到就好了。