CircRNA(circular RNA,环状RNA)是一类通常有一个以上外显子构成的环形RNA分子,是非编码RNA研究领域的一个新的研究热点,越来越多的研究人员投入到circRNA的研究。
大部分circRNA研究还处于起步阶段,因此需要系统的研究circRNA的形成、表达与功能。但是目前circRNA的研究,多集中于circRNA的鉴定以及circRNA的ceRNA功能,circRNA的生源机制并没有被足够重视。
基于此种现象,参考《细胞》“Complementary Sequence-Mediated Exon Circularization”,我们将为大家提供一套可行的circRNA生源机制研究策略。
目前报道的circRNA生源机制主要分为4类(图1):
(1)套索驱动环化;
(2)内含子配对驱动的环化;
(3)Circular intronic RNAs;
(4)RBP或反式因子驱动环化。
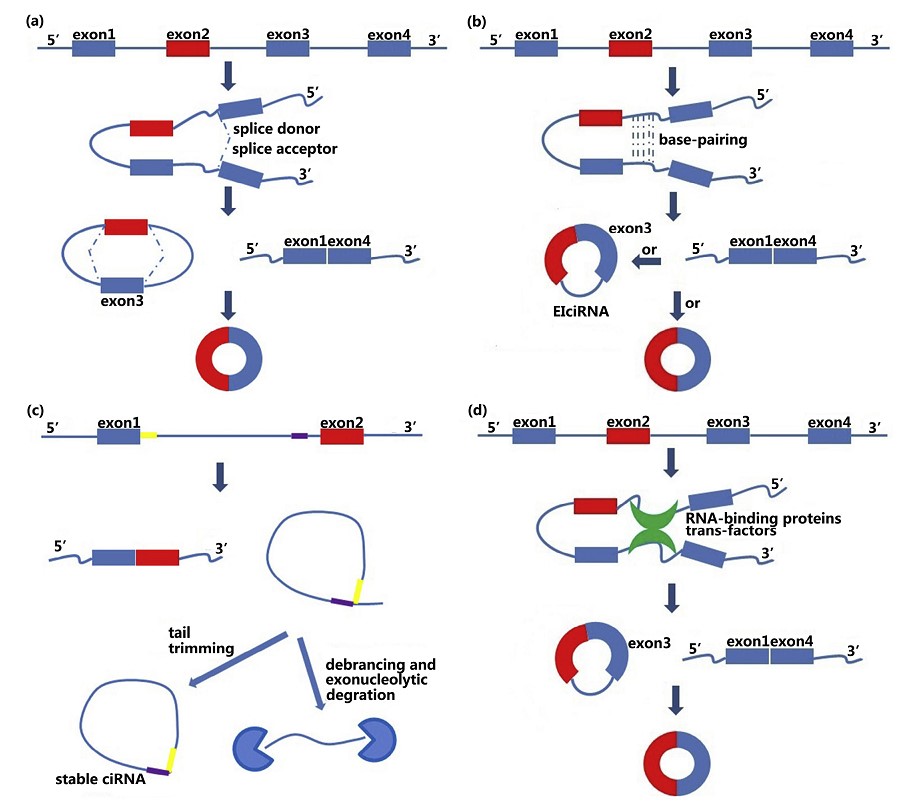
图1 circRNA生源机制
在4种circRNA生源机制中,内含子配对驱动的环化是一种重要的环化机制。已有研究表明,此种机制下,外显子环化主要依赖外显子侧翼的长内含子序列,而侧翼内含子序列包含的反向序列(如ALU序列)在内含子环化时起到重要作用。
参考《细胞》文章,我们认为可通过以下步骤来分析circRNA的形成是否来自内含子配对驱动的环化:
1、circRNA鉴定(包含在染色体中的定位信息)
2、circRNA侧翼intron序列提取
3、circRNA上下游intron反向互补序列分析
4、载体构建实验
这篇《细胞》文章都说了什么?
文章表明,可以环化形成circRNA的人外显子上下游侧翼序列,平均有3个ALU元件,同时这些ALU元件可以形成收敛和扩散IRAlus (inverted repeated Alus, 反向重复Alu元件),同时他们距离相邻外显子有相同的距离(图2)。而与之相反,选择未环化外显子侧翼内含子对(包含相同数量ALU元件)分析,发现形成的收敛、扩散IRAlus分布无相关性,因此推断IRAlus可介导外显子环化。
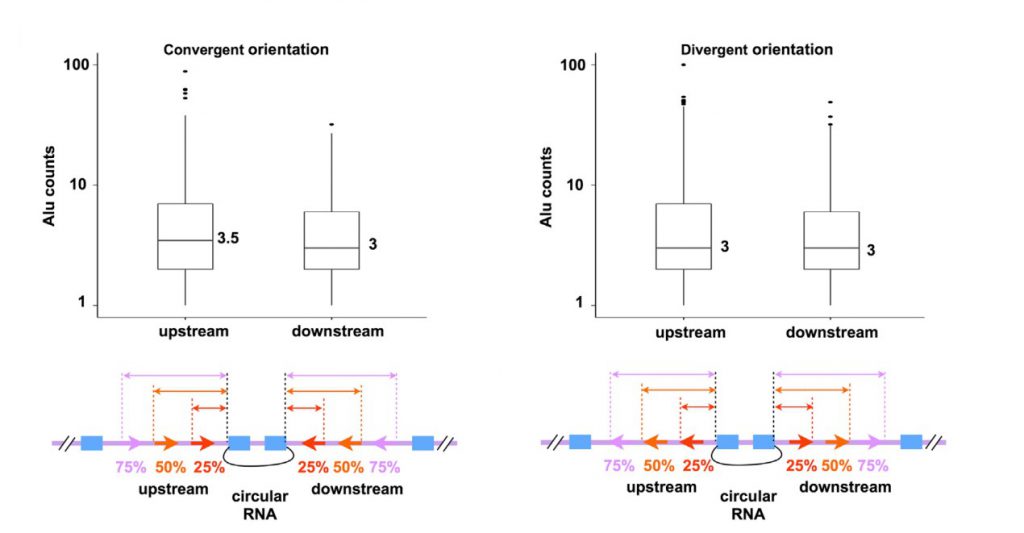
图2
而实验验证支持此项推断(IRAlus可介导外显子环化)。人类POLR2A基因某一区段可以转录circular RNA,转录出circular RNA的区段包含两个外显子,其上游内含子包含一段反向ALU序列,下游内含子包含两段正想ALU序列,形成的两种circular RNA具有相同自由能(图3 A)。克隆此区段序列后敲除不同ALU序列,然后构建载体后表达,利用NB和RT-PCR可以看到是否转录circular RNA(图3 B,#2、#5、#6、#7表明敲除后检测不到circularRNA,#3、#4表明敲除后可以检测到circular RNA)。
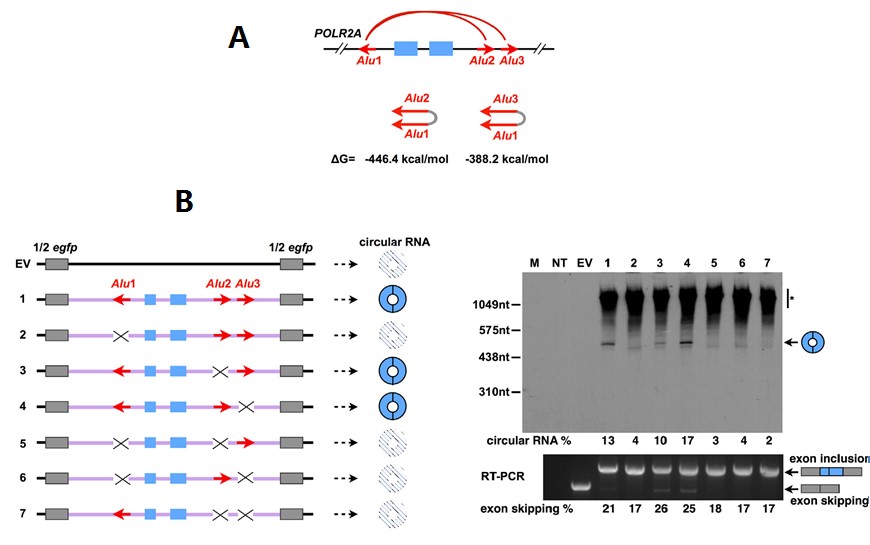
图3
除了完整ALU序列外,当只存在部分ALU序列时,依然可以检测出POLR2A circular RNA(图4,#2、#3);而当此区段ALU序列被来自NICN1基因3’UTR的ALU替换后,也可以检测到circular RNA(图4,#4)。
如果将基因POLR2A其他内含子中包含的非重复、互补序列插入POLR2A circular RNA去侧翼内含中,依然可以检测到circularRNA(图4,#5),但破坏此结构,几乎检测不到circular RNA(图4,#6)表明任何互补序列都可以介导circular RNA形成。
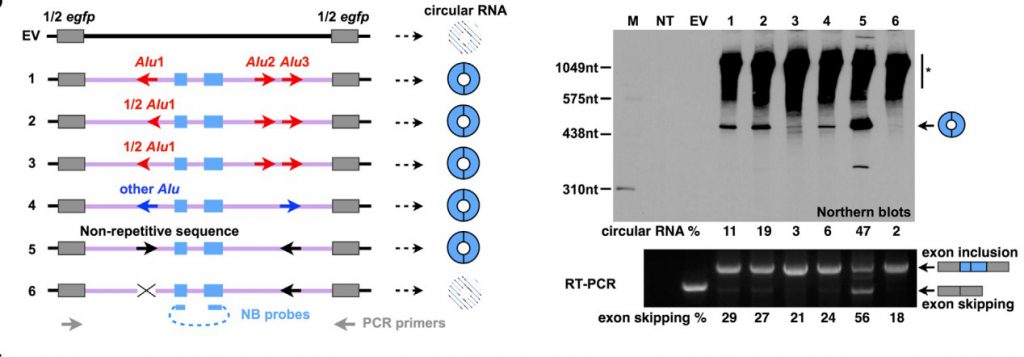
图4
IRAlus可介导外显子环化,但是存在IRAlus并不一定介导外显子环化(图5A)。图5展示人类基因ZWILCH 外显子上下游侧翼内含子上包含不同数量、不同AluJr元件,可以各形成3种类型IRAluswithin和3种类型IRAluacross,而小鼠基因ZWILCH则包含不同数量的B1和B2元件(SINE家族),可以形成3种类型IRAluswithin和6种类型IRAluacross(图5B)。跨外显子互补序列配对可以介导circularRNA形成(图5C 左),而相邻外显子间补序列配对只会产生正常线性RNA(图5C 右)。实验证明不同类型的互补序列配对类型彼此间存在竞争关系,影响circular RNA形成(图5D)。
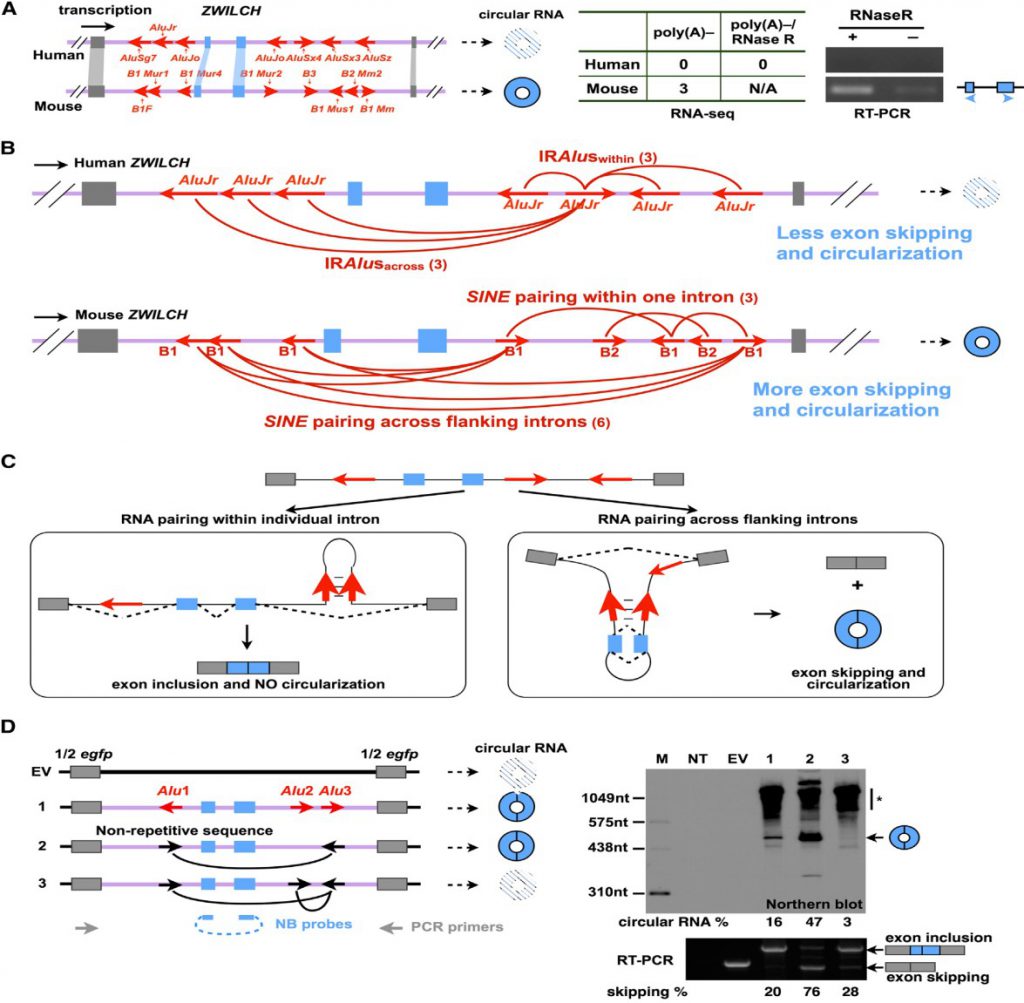
图5
参考文章:Zhang XO, et al. (2014) Complementary Sequence-Mediated Exon Circularization. Cell. 159(1): 134–147.
文章:联川生物





来第一个抢占沙发评论吧!