转载:锐博生物
结直肠癌(CRC)是一种常见的消化道恶性肿瘤,具有高发病率和死亡率。虽然CRC的诊断和治疗有所改善,但它仍然显著促成癌症相关的死亡。因此,揭示CRC癌变和转移的潜在机制可能为CRC管理提供新的见解。
环状RNA(circRNA)是近年来研究的热点,其特征在于单链闭环结构,目前已经鉴定了数千种circRNA, 且已提出circRNA的几种可能的功能,包括海绵体miRNA、结合蛋白质或编码蛋白质。大多数circRNA是外显子circRNA,其通过反向剪接从已知蛋白质编码基因的外显子区域衍生。由于其稳定且高度保守的特征,circRNA具有成为生物标志物的潜力。此外,某些circRNA在血浆和外泌体中丰富且稳定,为检测提供了更方便的途径。迄今为止,已经提出几种circRNA作为胃癌、肺癌和结肠直肠癌的诊断或预后的生物标志物。
南方医科大学李学农研究团队在The Journal of Pathology上发表了题为“Circular RNA circITGA7 inhibits colorectal cancer growth and metastasis by modulating the Ras pathway and upregulating transcription of its host gene ITGA7”的研究论文。结果表明circITGA7和ITGA7在CRC中的抑制作用,并且circITGA7通过抑制Ras信号通路和促进ITGA7的转录来抑制CRC细胞的增殖和转移,揭示了circITGA7作为CRC治疗的潜在靶标。
研 究 思路
验证circITGA7闭环结构:RT-qPCR、RNase R和放线菌素D处理
CircITGA7临床研究:RT-qPCR、ROC曲线分析
CircITGA7功能研究:构建稳定circITGA7过表达细胞、构建circITGA7或ITGA7稳定敲低细胞 (siRNA由RiboBio提供)
功能机制研究:RNA-seq、FISH(由RiboBio提供)、Fluorescent In Situ Hybridization Kit (由RiboBio提供)、核质分离、miRNA靶向circITGA7的预测
研 究 结 果
CircITGA7由ITGA7的外显子4通过反向剪接产生
本研究通过深度测序方法鉴定了circRNAs中下调幅度最大的circITGA7。随后设计特异性引物并进行了一系列实验来验证circITGA7具有不是通过反式剪接或基因组重排产生的闭环结构。结果显示circITGA7比线性ITGA7的抗RNase R消化能力更强。此外,使用放线菌素D抑制新的RNA合成进一步验证了circITGA7比线性ITGA7更稳定。这些数据表明circITGA7是环状RNA,它是由ITGA7的外显子4通过反向剪接产生的。
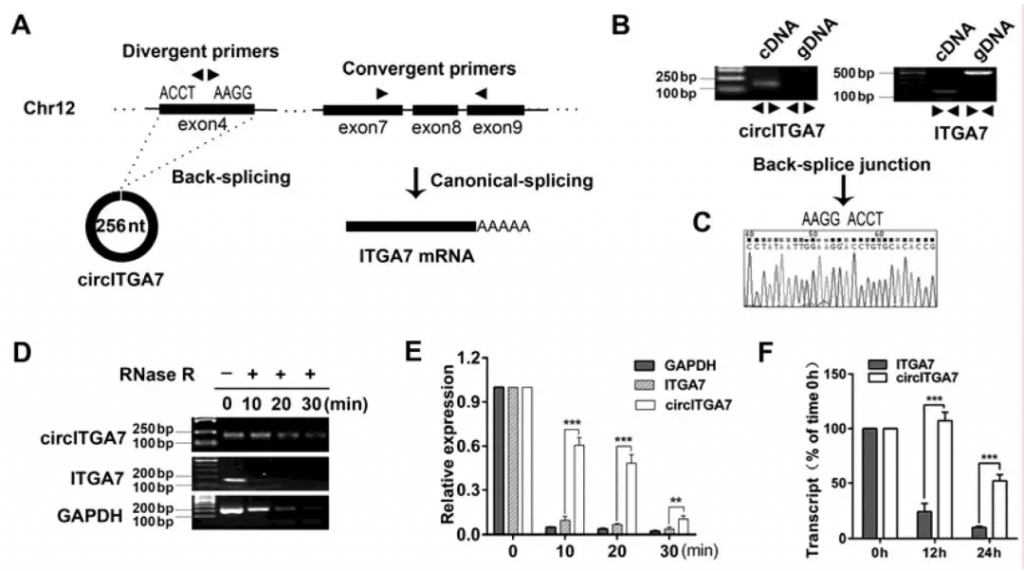
Figure 1. CircITGA7 is generated from exon 4 of ITGA7 by back-splicing
CircITGA7和ITGA7均在CRC中下调并与CRC进展相关
用RT-qPCR检测circITGA7和ITGA7在CRC组织及癌旁组织中的表达。结果显示,69例CRC组织中,67例circITGA7表达显著下调,48例CRC组织中,37例ITGA7表达显著下调,下调率分别为91.38%和58%。此外,7种CRC细胞系中circITGA7和ITGA7的表达也低于正常结肠直肠细胞系FHC的表达。
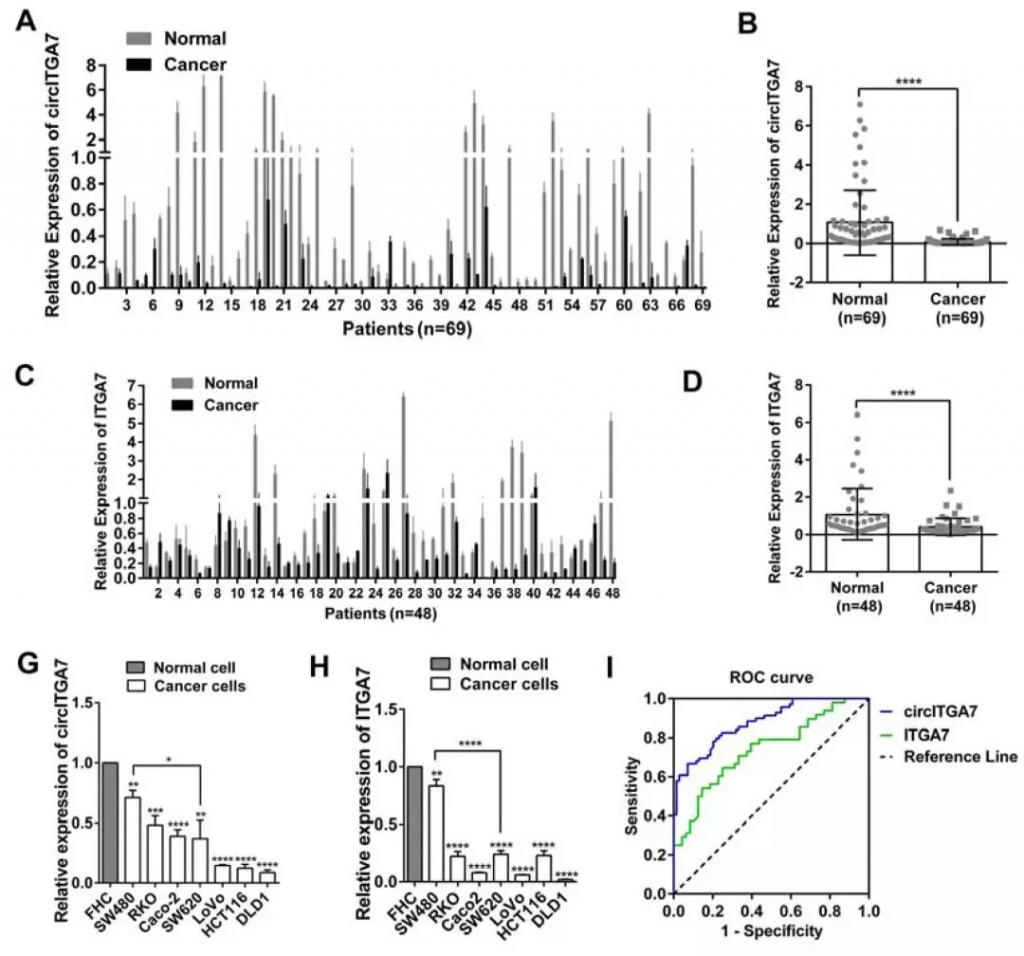
Figure 2. CircITGA7 and ITGA7 are both downregulated in CRC tissues and cell lines
为了进一步研究circITGA7和ITGA7在CRC中的潜在临床意义,使用circITGA7和ITGA7在CRC组织和成对的非癌组织中的相对表达来构建ROC曲线,以评估它们的诊断值。数据表明circITGA7具有作为CRC诊断的生物标志物的潜力。此外,circITGA7表达水平与肿瘤大小、淋巴结转移、远处转移和TNM分期呈负相关。然而,ITGA7的低表达仅与远处转移相关。这些结果表明,circITGA7和ITGA7在CRC中均下调并与CRC进展相关。
CircITGA7和ITGA7均抑制CRC细胞增殖和转移
构建circITGA7过表达稳转细胞系,流式结果表明circITGA7的过表达抑制了CRC细胞增殖。此外,伤口愈合、Transwell迁移和侵袭实验证明,circITGA7的过表达减少了细胞迁移和侵袭。这些数据表明,circITGA7的过表达在体外抑制了CRC细胞的增殖和迁移。与体外发现一致,circITGA7的过表达抑制体内皮下异种移植物生长。
相反,circITGA7的敲低促进了CRC细胞的增殖和迁移。在ITGA7敲低后观察到类似的结果。此外,circITGA7或ITGA7的稳定敲低均增强了异种移植物的生长。这些结果表明circITGA7和ITGA7均抑制CRC细胞增殖和迁移。
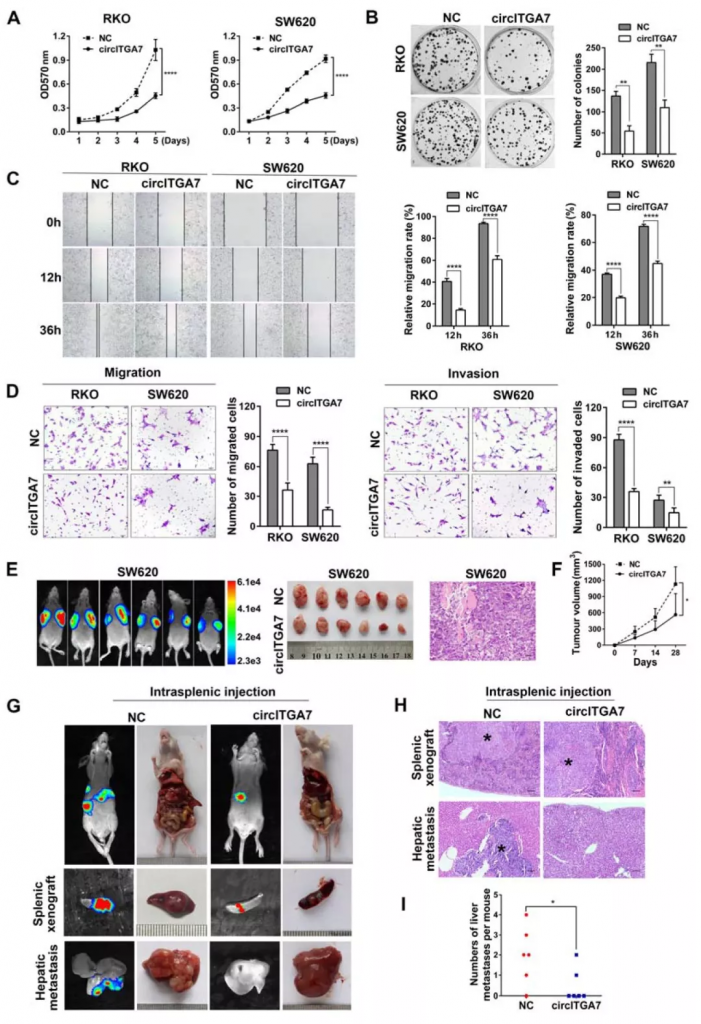
Figure 3. Overexpression of circITGA7 suppresses CRC cell proliferation and metastasis in vitro and in vivo
CircITGA7是Ras信号通路的负调节因子,而ITGA7参与调节细胞因子相关通路
KEGG富集分析表明,circITGA7敲低诱导的差异表达基因主要富集Ras信号传导途径。在ITGA7敲低细胞中,差异表达的基因富集在细胞因子相关通路。随后在SW620和RKO细胞中敲低circITGA7,发现Ras蛋白水平显著增加。此外,Ras的关键下游效应子(即ERK和AKT)的磷酸化相应地增加。在circITGA7的过表达后观察到相反的效果。这些数据表明circITGA7是Ras信号传导途径的负调节因子。
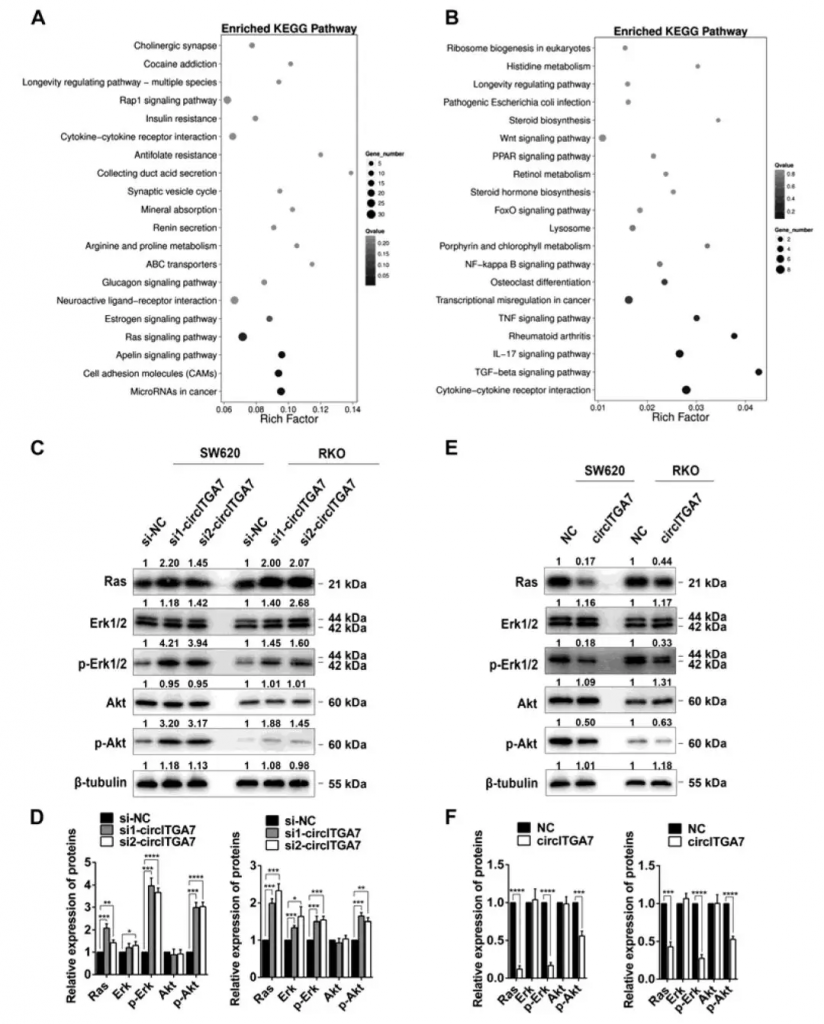
Figure 4. CircITGA7 is a negative regulator of Ras pathway while ITGA7 is involved in cytokine-related pathways
CircITGA7与miR-370-3p结合,通过上调NF1抑制Ras信号通路
FISH和RNA亚细胞定位分析显示circITGA7主要存在于CRC细胞的细胞质中,且circRNADb数据库预测circITGA7没有蛋白质编码潜力。因此,研究人员推测circITGA7可能通过与miRNA相互作用发挥功能。经过预测分析将目标锁定到miR-370-3p,已有研究表明MiR-370可靶向Ras1通路负调节因子NF1。因此,研究人员通过双荧光素酶报告基因测定及WB实验证明了circITGA7可以与miR-370-3p结合以增加NF1表达,从而抑制Ras途径。
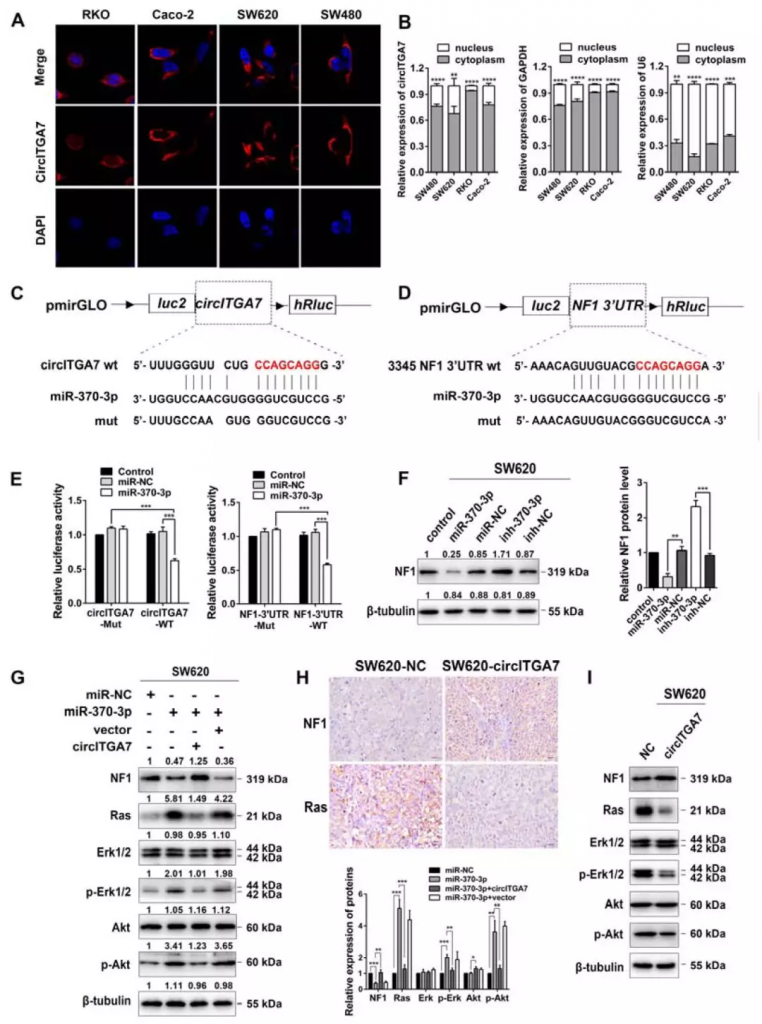
Figure 5 CircITGA7 binds to miR-370-3p to suppress Ras pathway by upregulating NF1 expression
CircITGA7通过Ras途径抑制RREB1来上调其宿主基因转录
利用CONSITE数据库及ChIP分析表明RREB1可与ITGA7启动子直接结合。RT-qPCR显示RREB1在CRC组织中上调。此外,RREB1表达与ITGA7或circITGA7表达呈负相关。然而,RREB1的敲除增加了SW480和RKO细胞中的线性ITGA7水平,但是没有改变circITGA7水平,这表明在circITGA7生物发生的反向剪接和ITGA7生物发生的常规剪接之间存在剪接竞争。
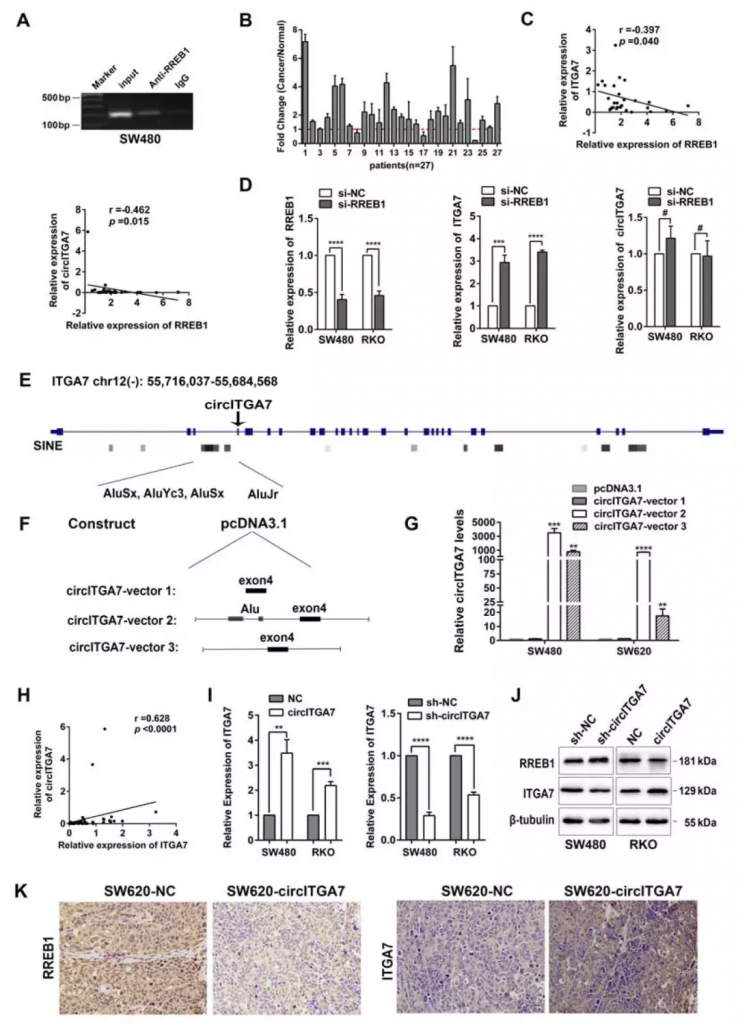
Figure 6. CircITGA7 upregulates its host gene ITGA7 transcription by suppressing RREB1 through Ras pathway
此外,研究人员推测circITGA7可能通过Ras途径抑制RREB1来增加其宿主基因转录。因此,分析了相同的46对CRC组织中的circITGA7和ITGA7表达,发现它们的表达之间呈正相关。此外,在circITGA7过表达细胞中观察到RREB1表达降低和ITGA7水平的增加。在敲低circITGA7后观察到相反的效果。表明circITGA7可以通过抑制Ras途径抑制RREB1来上调其宿主ITGA7转录。
参考文献:1. Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J
Clin 2015; 65: 87–108.
2. Wang PL, Bao Y, Yee MC, et al. Circular RNA is expressed across the eukaryotic
tree of life. PLoS One 2014; 9: e90859.
3. Chen LL, Yang L. Regulation of circRNA biogenesis. RNA Biol 2015; 12:
381–388.
4. Memczak S, Jens M, Elefsinioti A, et al. Circular RNAs are a large class of
animal RNAs with regulatory potency. Nature 2013; 495: 333–338.





来第一个抢占沙发评论吧!