作者:自生信草堂|微信公众号
自高通量测序及生物信息学的发展,circRNA被确认为一类新鉴定的非编码RNA,能够作为“miRNA-sponges”参与转录后调控。miRNA是一类通过结合3‘-UTR的种子区(seed region)下调靶基因mRNA的分子,而其本身同样受到体内复杂的调控网络约束。最新研究显示,Cdr1as能够作为一种内源性竞争RNA可以通过MREs结合miR-7。但是在体内, Cdr1as的功能尚待确定,报道首次以circRNA KO小鼠为研究对象,揭开circRNA在大脑中的调控机制。
文章发表于SCIENCE,影响因子41.058。题目为Loss of a mammalian circular RNA locus causes miRNA deregulation and affects brain function,文献分享将围绕Cdr1as展开,主要内容包括体内与Cdr1as互作的miRNA鉴定,Cdr1as的表达模式,KO小鼠模型的构建及干扰排除,敲除Cdr1as后对miRNA、靶基因及相关表型的影响,并解释为何在Cdr1as KO小鼠中,Cdr1as互作的miR-7下调而miR-671上调现象。这是首次circRNA序列完全敲除的案例报道。
知识累积
Cdr1as是一种环化的长链非编码RNA,在哺乳动物大脑内高水平特异表达且高度保守。在人类中,CDR1as主要定位在细胞质,包含超过70个miR-7的结合位点。作为海绵通过与miR-7部分互补形成复合体,从而使其不能与AGO2结合,降低游离的miR-7分子发挥调控功能。不同于miR-7,Cdr1as 与miR-671则通过完全互补结合的形式结合,可能参与沉默调控Cdr1as,并释放Cdr1as上结合的miR-7。
Cyrano是长链非编码RNA(lncRNA)包含单一、高度保守、几乎完全互补miR-7的结合位点。
PPI(a test of prepulse inhibition)是一种用于感觉运动门控的一种衡量标准,通过低强度预刺激(前脉冲)来检测惊厥反应的正常抑制中的缺陷,常用于神经精神疾病相关的内表型动物模型中。
实验方法概述
1. 使用CRISPR-Cas9技术通过显微注射至单细胞小鼠获得KO小鼠,sgRNA结合位点设计于Cdr1as剪切位点上游。Cdr1as KO菌株在纯C57BL/6N背景上产生并维持。并通过分子和电生理分析及行为研究对比KO小鼠及同窝出生仔WT对照小鼠之间的差异。
2. 新鲜冷冻的脑切片原位杂交(ISH)及免疫染色实验使用固定的核酸探针(locked nucleic acid probes)、通过PCR产物的体外转录获得的RNA及市售抗体。
3. 全细胞电压记录来自于体外第14到17天Cdr1as KO和 WT小鼠海马体神经。
4. 测序文库构建根据Illumina TruSeq流程,测序使用Illumina NextSeq 500 system。
5. miRNA差异基因表达使用程序包DESeq2。
6. 其余实验程序的细节,包含试剂和计算分析,包括支持参考文献,在补充材料的材料和方法详见
www.sciencemag.org/cgi/content/full/science.aam8526/DC1。
与Cdr1as互作的miRNA的鉴定
作者首先通过CLIP-seq方法及对预测的嵌合体 (chimera) 分析鉴定发现,在人和小鼠大脑中miR-7及miR-671靶结合的序列评分最高的为Cdr1as,证实两个miRNA与Cdr1as的互补形式上的差异,并指出结合位点序列具有高度保守性 (Fig. 1A)。同时结果显示miR-7与lncRNA Cyrano (1700020I14Rik)互作得分仅次于Cdr1as,暗示Cyrano可能同样参与miR-7的调控。
小鼠大脑中Cdr1as的表达模式探索
作者通过使用神经标记物下的RNA荧光原位杂交(FISH)实验验证Cdr1as在大脑中的表达模式。结果显示Cdr1as在兴奋性神经元中高水平表达,但在神经胶质细胞如少突胶质细胞和星形胶质细胞中不表达;在皮层,海马,中脑和后脑中,神经元VGLUT1和VGLUT2均表达Cdr1as (Fig. 1B)。而在原代皮层神经元中的单分子RNA FISH实验中,Cdr1as 在胞体及轴突中均有表达,暗示其在不同的亚细胞定位中能够发挥调控功能 (Fig. 1C, left)
KO小鼠模型
作者KO采用的方法为CRISPR-Cas9技术,因此首先对反义链转录干扰问题进行探索。作者针对小鼠大脑的4个区域构建了24个链特异性RNA文库并测序,通过设计Cdr1 mRNA 互补探针的原位杂交(ISH),并结合RNA数据、表达基因的cap信息及染色质修饰数据进行分析,结果显示Cdr1as与反义链转录本间并无联系。随后作者通过genotyping, ISH (Fig. 1D), Northern blot analysis验证Cdr1as的敲除,并通过qRT-PCR进行定量验证KO情况,最终获得成活、具有生殖能力且脑部解剖中没有出现异常KO小鼠。
由于Cdr1as与X染色体关联,因此作者通过定量验证了敲除小鼠在雄性和雌性中的差异,结果显示野生型雌雄个体的Cdr1as 表达一致,而在杂合子雌性小鼠中,Cdr1as 表达较野生型水平降低一半,因此作者使用敲除后的雄性小鼠作为后续分析对象。
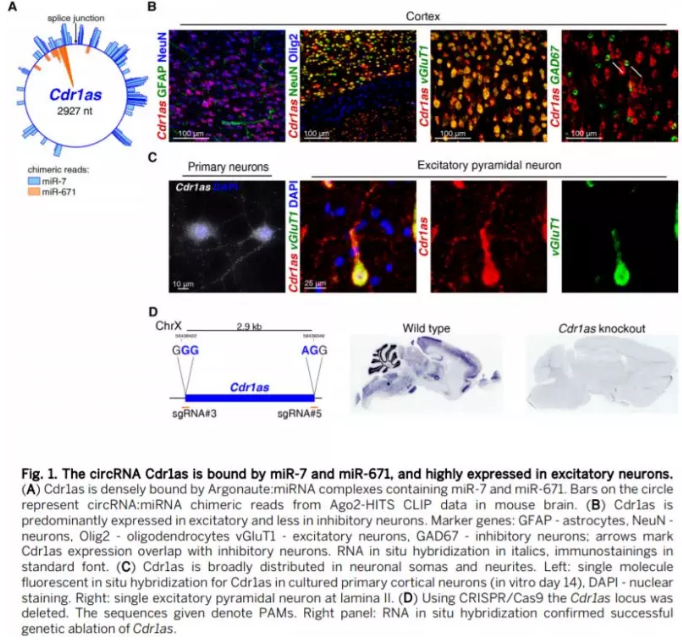
Cdr1as KO对miR-7和miR-671的影响
首先作者通过对Cdrlas在大脑中高表达的四个区域(小脑、皮质层、海马体和嗅球体)miRNA测序数据比较miR-7在野生型及KO小鼠间的表达差异,结果显示具有相同前体而形成不同成熟体的miR-7a-5p 和miR-7b-5p在所有的样本中均下调,并具有高度保守性。在所有鉴定的miRNA中,除miR-7a-5p、miR-7b-5p外仅有8个miRNA显著下调,但是该现象只出现在皮质层中。其次通过Northern blot (Fig. 3A), ISH (Fig. 3, B and C), qRT-PCR分析及测序数据分析证实在四个大脑区域中确认miR-7下调且调控转录后过程。不同于miR-7的表达,miR-671-5p KO小鼠大脑的小脑、皮质层和嗅球体三个区域中表达上调,且高度特异参与转录后调控。
随后作者对非脑组织 (肺,骨骼肌,脾脏,心脏和脊髓) 中,Cdr1as敲除后miR-7及miR-671 水平的变化,只有在脊髓中实质上改变了miR-7的表达,且只有脊髓中的Cdr1as表达与神经元中一致。
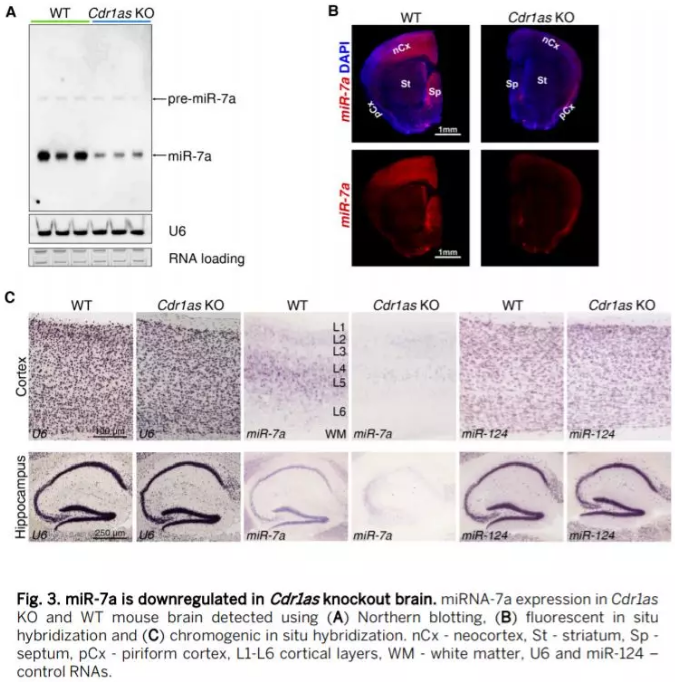
Cdr1as KO对靶基因的影响
通过对大脑四个区域的mRNA测序分析,作者得到敲除Cdr1as 后对靶mRNA的影响。miR-7靶基因包括Fos 、Nr4a3 、Irs2 及Klf4 在cortex, cerebellum, and olfactory bulb 中显著下调(Fig. 4, A to D)。miR-7是细胞周期及IEGs例如Fos基因的调控抑制子,且IEGs与与神经元活动增加密切相关,因此作者通过qRT-PCR assays、Nanostring首先对测序数据真阳性进行验证,Western blots (Fig. 4E)及进一步的免疫组化 (Fig. 4F)验证c-Fos and EGR1蛋白在大脑各个区域的表达发现,在KO大脑中,c-Fos蛋白显著被抑制。
在KO小鼠的非脑组织中,IEGs的表达水平并没有改变,因此Cdr1as 表达是大脑特异的。除了IEGs外,在KO小鼠中一些生物钟基因如Per1 and Sik1 始终上调,Dbp始终下调,这些在前脑区域表达与小鼠睡眠剥夺和延长清醒时间有关。
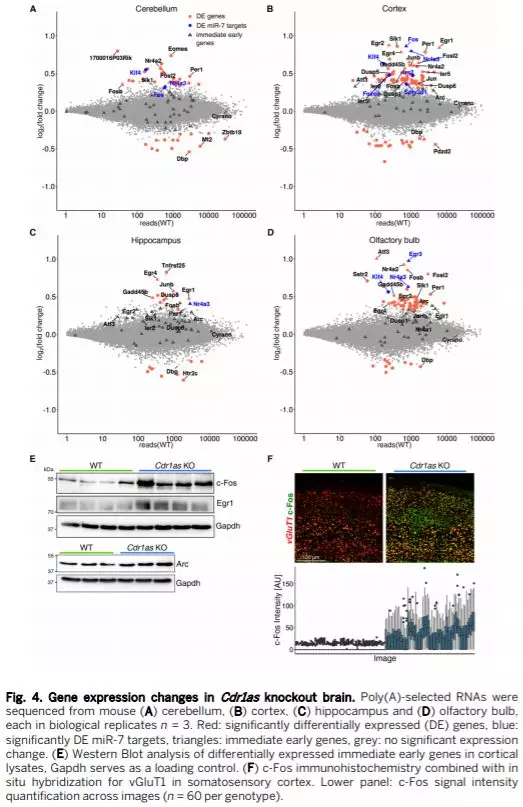
Cdr1as KO对突触兴奋传递功能的影响
随后作者通过对单个海马神经元兴奋性突触后电流的研究 (EPSCs) 来判断Cdr1as KO小鼠兴奋性突触传递功能障碍。在二倍EPSC频率(Fig. 5A) 而不改变振幅的情况下,自发囊泡释放强烈上调。通过钙诱发的突触反应,Cdr1as KO的神经元EPSC振幅没有显著改变(Fig. 5B, left),且囊泡释放的概率及大小没有显著改变,较高的自发释放并不依赖于突触形成或者囊泡发生。这些电生理学记录表明Cdr1as敲除能够导致兴奋性突触传递功能障碍。
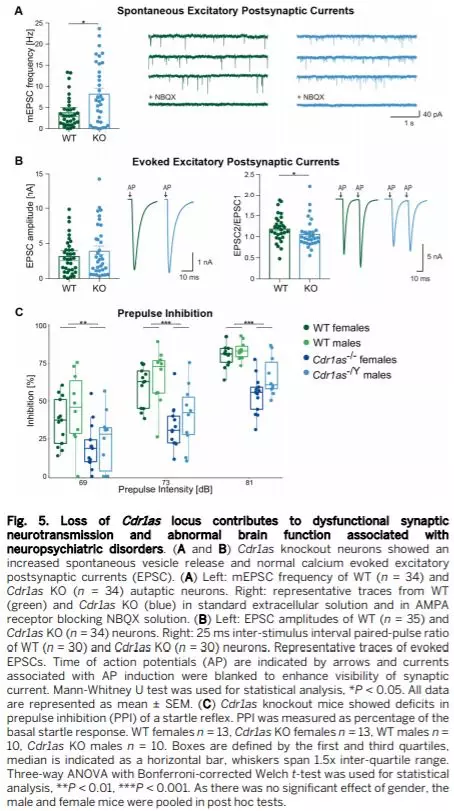
Cdr1as KO对神经精神类行为的影响
观察发现,Cdr1as KO小鼠表现出正常的社交行为,未受影响的焦虑水平,在开放式野外测试中KO小鼠运动活动未受干扰,识别记忆或探索行为也无明显缺陷。但对惊恐反应的前脉冲抑制(PPI)的测试中,三种前脉冲强度下WT和Cdr1as与KO小鼠(雄性和雌性)之间的显著且强烈的差异(30-50%)(Fig. 5C) 。
实验数据显示Cdr1as KO动物表现出与神经精神疾病相关的行为表型,即强烈的感觉运动门控缺陷。而Fos、IEGs等与神经元活动增加密切相关,因此Fos,Egr1和Egr4等IEG的上调与PPI降低有关。
讨 论
1. 作者使用CRISPR / Cas9技术首次完全删除circRNA的全长序列获得敲除小鼠,可能还是存在着一些尚未解决的问题:
a. 反义链干扰
虽然已验证了反义链无法转录出Cdr1as,但是完全敲除Cdr1as基因座所带来的影响可能并不仅仅导致Cdr1as KO,即Cdr1as可能能够转录出其他不同的转录本。
b. 脱靶效应
目前没有直接的证据排除脱靶效应,但是作者通过几项观察到的分子和行为表型反向论证,大致如下:
(1)Cdr1as相关的miRNA表达皆出现变化;
(2)早期基因(Immediate early genes, IEGs)包含miRNA-7的靶基因在突变体大脑中上调,但是在其他组织(Cdr1as表达很低)并表现上调;
(3)这些IEG与观察到的神经精神症状-前脉冲抑制受损(PPI)有关;
(4)Cdr1as仅在神经元而非神经胶质细胞中表达,表明Cdr1与miRNA的相互作用在神经元中起作用,因此与观察到的PPI缺陷和突触传递功能障碍一致。
2. Cdr1as 作为ceRNA在KO模型中的表现与预测不符
首先作者推测这是由于Cdr1as序列上存在两个miRNA的结合位点,且两者在Cdr1as上的结合位点不同。作者推测由于lncRNA Cyrano促进和调节所导致的,原因如下:(1)嵌合物分析流程中,Cyrano是评分第二高的miR-7相互作用物;(2)Cyrano在表达Cdr1as的所有组织中都很好地表达;(3) Cyrano上的miR-7结合位点类似于Cdr1as上的miR-671结合位点,具有极其保守的结构。
3. Cdr1as敲除后对immediate early genes (IEGs)的影响
IEGs 的上调包含Klf4, Nr4a3 and Irs2基因,虽然都为miR-7的靶基因,但是不足以解释这些基因的大量上调的现象,在其他报道中,敲低Cdr1as后HEK293细胞中miR-7靶标被抑制。作者认为,组成型的Cdr1as被敲除时,miR-7分子不能被circRNA稳定时极可能出现反转现象,即导致miR-7靶基因上调。同时miR-671可能通过sponged miR7:AGO 复合物在特定的条件下切割Cdr1as,从而调节miR-7及靶基因。
小 结
作者首次以circRNA完整序列KO小鼠模型为研究对象,CRISPR / Cas9技术应用于circRNA编辑具有很高的参考价值。并最终得到如下结论:(1)在机制上,Cdr1as调节miR-7在神经元中的稳定性或转运,而miR-671通过调节Cdr1as水平调控miR-7水平。(2)在功能上, Cdr1as及其与miRNA的直接相互作用参与感觉运动门控和突触传递关键过程。同时作者发现了几个有趣的现象,如KO小鼠大脑中同时出现了生物钟调节基因失调,以及差异表达的miR-200家族和IEG都与癌症相关,深入研究对癌症模型的构建可能具有极大意义。
参考文献:Piwecka Monika, Glažar Petar, Hernandez-Miranda Luis R et al. Loss of a mammalian circular RNA locus causes miRNA deregulation and affects brain function.[J] .Science, 2017, 357(6357).





来第一个抢占沙发评论吧!