解读: |
Twist1 regulates Vimentin through Cul2 circular RNA to promote EMT in hepatocellular carcinoma
Twist1通过环状RNA circ-10720调控Vimentin(波形蛋白)进而促进肝癌的上皮间质转换
期刊:Cancer Research;影响因子:9.13
发表单位:南开大学
1、摘要
Twist1是epithelial-mesenchymal transition (EMT,上皮间质转化)过程中重要的转录因子,可以提高Vimentin(波形蛋白)的表达,但其中的机制并不清楚。本研究发现Twist1可以调控环状RNA Cullin2 (Cul2) 进而提高EMT过程中Vimentin的表达。Twist1可以结合到基因Cul2的启动子区,选择性的激活Cul2的环状转录本(circ-10720) 而非mRNA。circ-10720与Twist1的表达,肝细胞癌恶化程度、不良预后呈正相关。Twist1可以通过提高circ-10720的表达水平促进Vimentin的表达,circ-10720可以海绵吸附调控Vimentin的microRNA。体外实验,异种移植小鼠模型中敲低circ-10720可以减弱Twist1促进肿瘤发展的能力。数据揭示了EMT过程中Twist1调控Vimentin的机制,为肝癌治疗提供了新的靶点,为研究基于circRNA的诊断和治疗提供了新的角度。
2、 研究背景
Epithelial-mesenchymal transition (EMT) 是肿瘤转移所必须的,涉及到细胞重编程过程,上皮细胞改变其形状,提高运动能力并获得间质细胞表型。Twist1是EMT过程中重要的转录因子,通过靶基因启动子的激活或抑制控制EMT相关基因,上调间质细胞表型相关的基因如Vimentin。Vimentin是一个3型中间丝蛋白,是EMT间质细胞marker。Vimentin可以驱动细胞柔软性,与不良预后和高频转移有关。目前,一些重要的cis元件和相关的转录因子与Vimentin的表达相关。比如Sp1/Sp3结合GC-Box 1,Stat1/Stat3结合ASE,c-Jun可以与AP-1家族形成homo- or heterodimers结合到AP-1位点,所有这些都可以增加Vimentin的转录。另外,磷酸化的Slug不能直接结合到Vimentin启动子区,可以调控其他的转录因子上调Vimentin表达。证据表明EMT过程中Twist1可以上调Vimentin表达,但机制并不清楚,也没有明显的证据说明Twist1可以结合到Vimentin启动子区。
Cullin2 (Cul2) 是multiple ECS (ElonginB/C-CUL2/5-SOCS-box protein) E3泛素蛋白连接酶复合物核心成分之一,可介导多个蛋白泛素化。预测Cul2是个肿瘤抑制蛋白,可以降解泛素化HIFα 。然而,有报道称Cul2是正常血管生成中所需要的,并与细胞周期调控有关。近些年认为circRNAs是转录后水平基因调控的重要分子。circRNAs来源于非常规的可变剪接,某外显子的供体连接点与上游外显子受体连接。证据显示一些circRNAs可以发挥调控miRNAs的功能。有报道显示circRNAs可以与线性RNA竞争剪接进而调控基因表达。然而Cul2及其circRNAs在肿瘤发展中的作用并不清楚。
本研究,我们发现Twist1通过结合Cul2启动子上调Cul2 circRNAs表达,抑制Cul2 mRNA表达促进Cul2转录。我们发现circ-10720与Twist1表达正相关并促进EMT过程。circ-10720通过吸附靶向Vimentin 的miRNAs上调Vimentin的表达。我们发现敲低circ-10720会阻碍Twist1对Vimentin的正调控。本研究描述了一个新的Twist1-circRNA-Vimentin调控机制,并提供间质肿瘤新的潜在的治疗靶点。
3、 材料方法
1、 细胞培养和质粒转染
PLC-PRF-5和SMMC-7721细胞系在RPMI-1640培养基上培养,HEK-293T细胞在Dulbecco’s modified Eagle’s培养基上培养,并添加10% (v/v)胎牛血清,37 °C,5% CO2,湿润空气中培养。PLC-PRF-5, SMMC-7721 和 HEK-293T解冻后分别传代约35, 42和24。细胞均经过肝癌细胞形态学,分子标志物,生长曲线鉴定,及支原体检测。质粒信息在Supplementary Table S1中。circ-10720 siRNA引物在Supplementary Table S2 中。合成siRNA, miRNA和突变的miRNAs。Lipofectamine 2000或nanoparticle转染试剂转染质粒和miRNA。circ-10720慢病毒载体pLCDH-ciR及辅助载体psPAX2, pMD2.G转入HEK-293T细胞。48h后收集病毒上清,超速离心进行过滤和浓缩。

2 、qRT-PCR
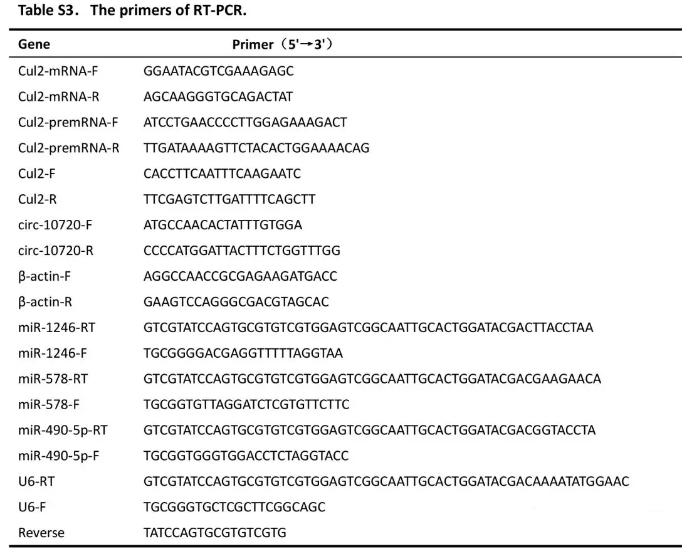
TRIzol提取total RNA,Quantscript RT试剂盒使用Oligo(dT), random或miRNA-specific stem-loop primers合成cDNA。SYBR RT-PCR kit进行转录本定量。2-ΔΔCT计算表达水平,U6或β-actin作为内参。引物列表在Supplementary Table S3。
3 、双荧光素酶基因检测报告基因检测
重组双荧光素酶报告质粒包含Cul2 启动子(pEZX-PG04-Cul2) ,Vimentin 3’-UTR (psiCHEK-2-Vimentin-3’UTR) 潜在miRNA结合位点,和circ-10720 (psiCHEK-2-circ-10720) 。Cul2启动子和Twist1过表达或敲低载体分别转入到PLC-PRF-5和 SMMC-7721细胞中。48h后,双荧光素酶报告基因试剂盒检测荧光素酶和分泌型碱性磷酸酶。Vimentin 3’-UTR,circ-10720荧光素酶报告载体and miRNA mimics转入到HEK293T细胞中。海肾萤光素酶作为对照进行转染效率校正。48h后试剂盒检测荧光素酶活性。
4、 细胞侵袭实验
使用24孔侵袭板进行细胞侵袭实验。转染48h后,PLC-PFR-5 and SMMC-7721细胞胰蛋白酶消化,转移到Matrigel基质胶包被的上层小室中,小室含有100ul无血清培养基。FBS加入到下层小室作为引诱物。24h后,下层小室细胞使用4%多聚甲醛固定,而后使用0.1%结晶紫染色。对下层小室表面的细胞随机选取5处进行计数。每个实验重复三次。
5、 细胞划痕实验
转染24h后,用微量吸管对小室划线。通过测量细胞运动到划线区的数量评估细胞迁移能力。
6、 免疫荧光实验
PLC-PRF-5 and SMMC-7721细胞使用含3.7%福尔马林的PBS室温固定5分钟,而后1%牛血清白蛋白封闭30分钟,Vimentin抗体,Ecadherin抗体4℃孵育过夜,而后FITC- and TRITC-labeled的二抗室温孵育1h。每一步都进行2次5min PBS清洗。而后DAPI复染2分钟,显微镜观察。
7 、染色质免疫沉淀实验
1 × 107 SMMC-7721细胞进行ChIP-Seq实验。将细胞1%福尔马林交联10分钟,0.25 M甘氨酸终止交联并用冷PBS冲洗。细胞团重新悬浮到1ml含有1×蛋白酶 Inhibitor Cocktail II细胞裂解液中,冰上孵育15分钟,吸管吹打,800 × g 4℃离心5分钟。细胞团悬浮于1ml核裂解液中。超声波破碎染色质,并用Bioanalyzer评估。将部分染色质与anti-Twist1单克隆抗体孵育4℃过夜。将protein/DNA复合物解交联获得游离DNA。微型离心柱纯化,DNA片段高通量测序。
8、 Western blotting实验
PBS冲洗细胞,含protease Inhibitor Cocktail预冷裂解液冰上裂解细胞30分钟。电泳分离裂解液并转移到PVDF膜上,Cullin2、Twist1、Vimentin、GAPDH等抗体封闭,并4℃过夜,而后HRP-conjugated goat anti-rabbit IgG secondary antibody室温孵育1h。增强化学发光基质评估蛋白质表达。
9 、人源肿瘤异种移植模型(PDTX model)
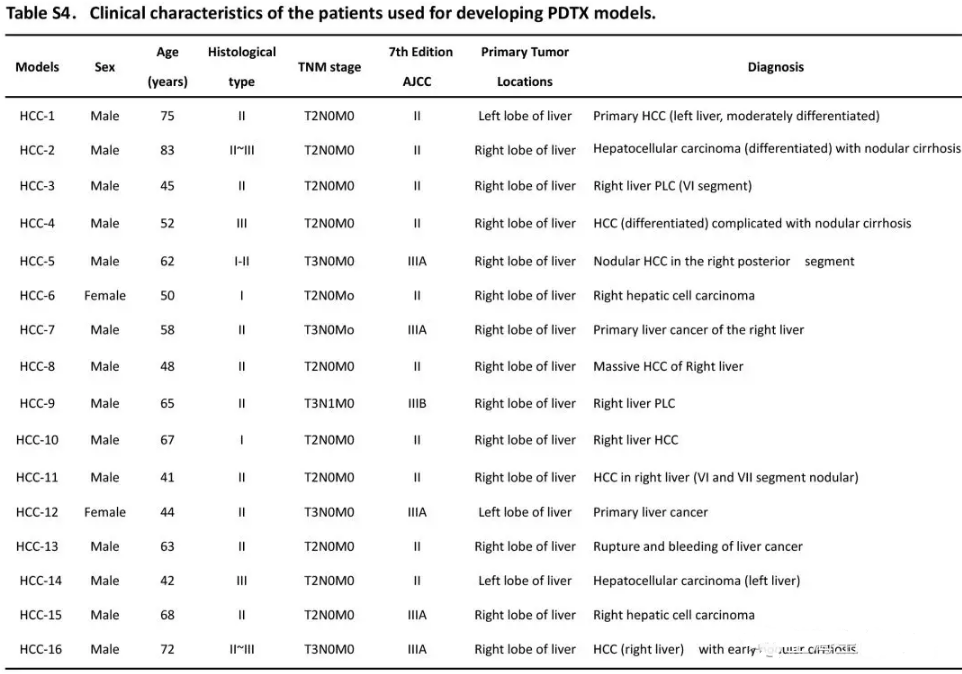
收集手术切除的新鲜肝肿瘤组织。遵从Helsinki声明,研究得到了伦理委员会的支持,包括使用动物实验和肿瘤样品,并得到病人知情同意。病人信息如Supplementary Table S4。依据qPCR定量选择8个Twist1低表达组织和8个Twist1高表达组织,而后将肿瘤分为两组(Twist1-Low group, Twist1-High group) ,并切成1–2 mm3 小块,置入含抗生素的RPMI培养基中。将肿瘤小块移植到免疫缺陷小鼠的下背皮区。肿瘤长到100 – 200 mm3时,样品体内传代构建F2肿瘤,而后同理构建F3代。当F3肿瘤长到100 – 200 mm3,1×107 TU含有circ-10720慢病毒的载体HBSS注射到Twist1低表达组(Twist1-Low+circ-10720 groups) ,(Twist1-Low+control group) 作为对照。10OD circ-10720 siRNA 注入到Twist1-High组(Twist1-High+circ-10720 siRNA groups) ,control siRNA (Twist1-High+control siRNA group) 作为对照。每组4只,三天注射一次,处理18天。ELISAs检测血清 α-fetoprotein (AFP) 表达量。数字卡尺每三天测量一次肿瘤直径,V= (L × W2)/2 公式计算肿瘤体积。第24天杀掉小鼠收集肿瘤组织,10%福尔马林固定并石蜡包埋。剩余组织-80℃冻存用于RNA提取。
10、 二乙基亚硝胺(DEN)诱导的TetOn-Twist1小鼠肝癌模型
使用位点特异性的单拷贝整合策略构建TetOn-Twist1小鼠。对14-15天小鼠注射DEN(20 mg/kg body weight) 引起肿瘤产生。两周后,每两周注射苯巴比妥类TCPOBOP(3 mg/kg body weight) ,共7次促进小鼠肿瘤生长。而后,肝癌小鼠自由分成两组。一组6个小鼠无伟霸霉素薄膜片水饲养(对照组),第二组12个小鼠有伟霸霉素薄膜片水饲养(Twist1组),7天的无伟霸霉素薄膜片治疗后,Twist1组一半的小鼠静脉注射si-circ-10720 (10OD) ,另一半注射对照siRNA。两周后宰杀,取肝组织检测肿瘤数量并10%福尔马林固定石蜡包埋。
11 、免疫组化
二甲苯石蜡组织脱蜡,梯度降低的酒精水化 。然后3%过氧化氢封闭内源性过氧化物酶活性。微波抗原修复技术修复抗原。封闭后,1抗(Twist1、E-cadherin、Vimentin)孵育4℃过夜。阴性对照使用PBS代替1抗。随后使用HRP-polymer anti-mouse/rabbit IHC kit连接二抗,室温孵育1h。而后样品使用二氨基联苯处理,苏木精染色,中性树胶封片。通过密度(0=negative, 1=canary yellow, 2=claybank, 3=brown) 和阳性细胞比例得分(1=less than 25%, 2=25% to 50%, 3=51% to 75%, 4=more than 75%) 计算组化得分。
12 、荧光原位杂交
含381例肝癌组织芯片进行免疫组化和荧光原位杂交。circ-10720, circ-31603, circ-12201, circ-21832, circ-20827, and circ-31230 的表达水平使用FAM标记的核酸修饰的circRNA探针进行原位杂交。共焦显微镜评估circ-10720染色及表达情况。原位杂交探针如Supplementary Table S5。

13 、扫描电镜
细胞生长在爬升膜上,转染circ-10720 or si circ-10720。48h后,细胞固定并用醋酸酯水化,而后梯度酒精脱水。包金后,细胞使用扫描电镜观察。
14 、统计分析
GraphPad Prism 6 and SPSS v. 19进行统计分析,Student’s t-test, one-way ANOVA, Pearson’s correlation, chi-square, and Kaplan-Meier等计算统计学差异。P < 0.05认为有意义。
4、 结果
1、 circ-10720的表达与肝癌病人转移和预后有关
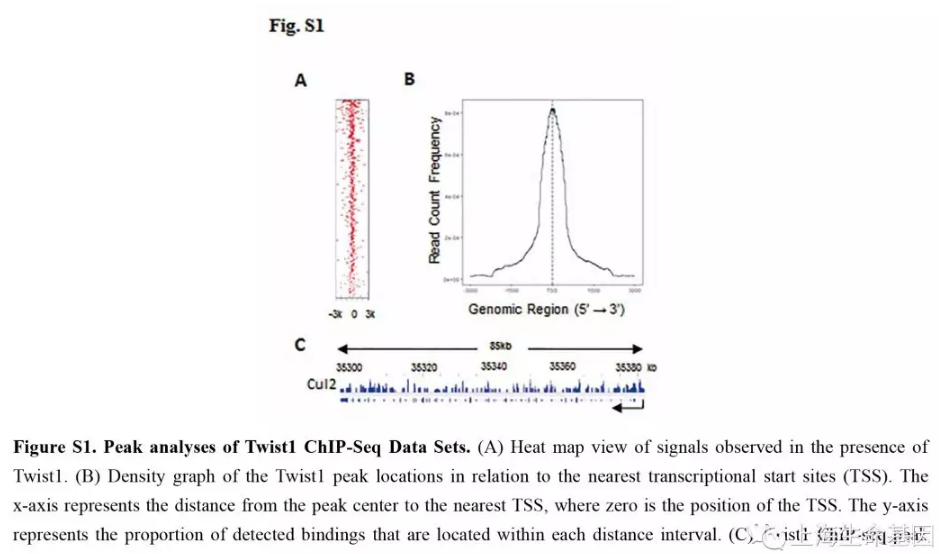
为了研究Twist1的调控功能,我们分析了Twist1全基因组上可能的靶标。对SMMC-7721 细胞使用Twist1抗体基于染色质免疫沉淀(ChIP)进行深度测序(ChIP-seq)。我们分析了Twist1基因组特征,显示Twist1在Cul2启动子的结合区,如Figure 1A和Figure S1A-C。SMMC-7721细胞特殊抗体的ChIP-PCR分析Twist1对Cul2启动子区的作用,验证了ChIP-seq结果(Figure 1B)。进一步我们使用双荧光素酶报告系统检测了Twist1对Cul2启动子区的作用。结果显示过表达Twist1可以增强Cul2启动子活性,下调Twist1减少Cul2启动子活性(Figure 1C)。
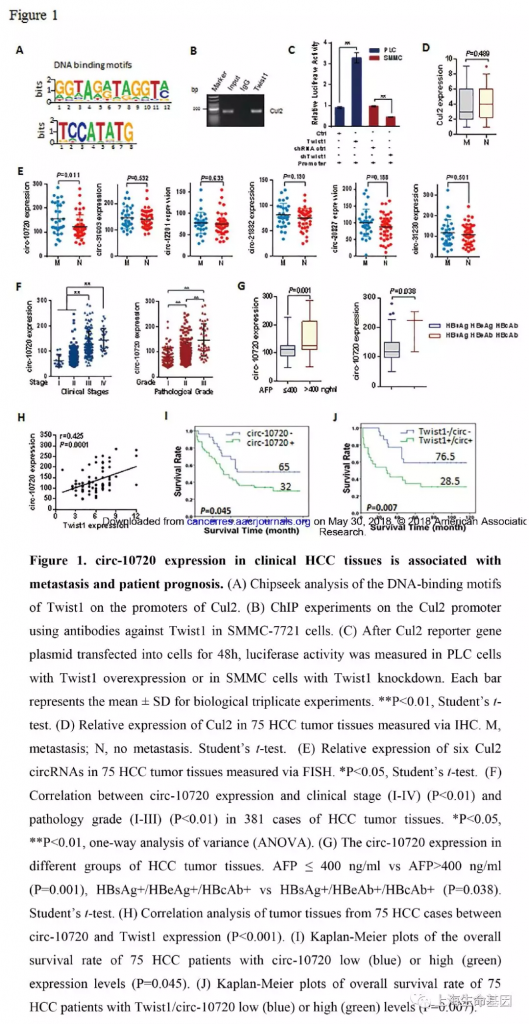
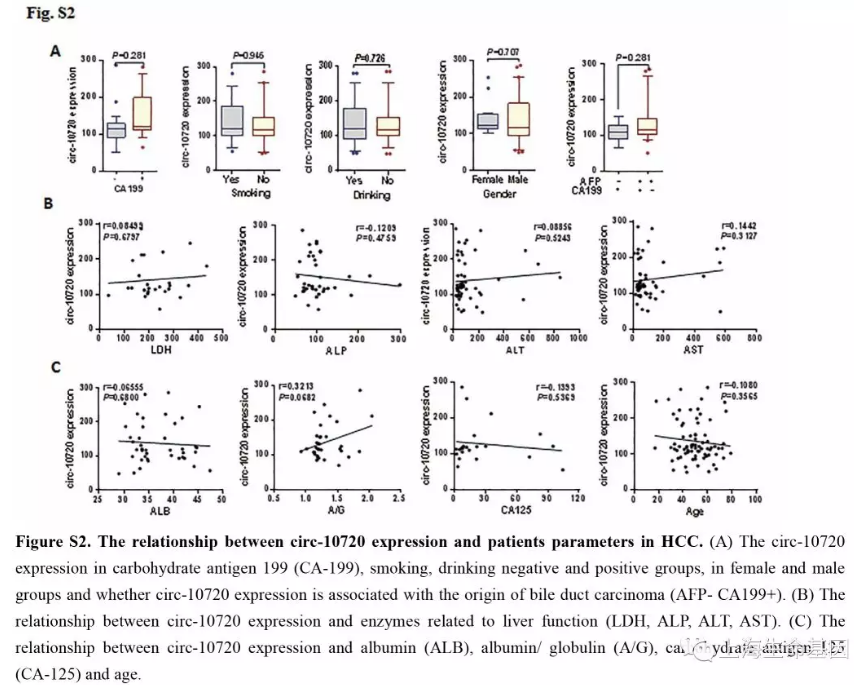
为了分析肝癌组织中Cul2的表达谱及与肝癌恶化的关系,我们研究了75个肝癌样品。尽管Twist1可以调控Cul2启动子活性,但在转移与非转移的样品中Cul2的表达没有显著差异(P=0.489) (Figure 1D) 。因此我们猜测是Cul2产生的环状RNA在肝癌发生中发挥重要作用。我们预测了几个circRNAs,并对7个进行了检测,发现circ-10720有显著变化(P=0.011)(Figure 1E)。 因此,本研究我们主要研究circ-10720在肝癌发展中的表达和功能。circ-10720在381个肝癌肿瘤组织中临床分期和病理分级中是呈现增加趋势。进而,我们研究了circ-10720在不同肝癌肿瘤分组中的表达,发现在AFP-positive (AFP>400 ng/ml) and HBsAg+/HBeAb+/HBcAb+分组中上调。结果说明,circ-10720的表达与AFP (P=0.001) and hepatitis B markers (P=0.038) (Figure 1G) 相关。同时我们分析了circ-10720与其他因子如age, sex, smoking, drinking, carbohydrate antigen(CA-199, CA-125), enzymes 的关系。结果显示没有显著联系(Supplementary Figure S2A-C) ,总之,上调表达的circ-10720或与肝癌的侵袭有关。
进一步统计分析发现肝癌组织中circ-10720的表达水平与Twist1的表达水平呈现正相关(r=0.425, P=0.0001) (Figure 1H) 。同时我们也研究了生存时间与circ-10720、Twist1表达水平的关系,Kaplan-Meier生存曲线显示,高表达circ-10720与不良预后有关(Figure 1I) 。高表达的circ-10720、Twist1会缩短生存时间,生存时间中值从32个月下降到28.5个月(Figure 1J) 。结果显示Twist1与circ-10720的表达水平并不完全同步,Twist1或许可以通过调控其他蛋白或circRNAs影响肝癌病人生存时间。
2、 Twist1调控circ-10720影响肝癌细胞癌进展
为了确定Twist1是如何调控circ-10720的,我们研究了Cul2基因的pre-mRNA,mRNA,circ-10720,引物设计图如Figure 2A。Twist1过表达可以提高PLC细胞Cul2基因pre-mRNA的表达量,其敲低表达可以减少pre-mRNA的表达量(Figure 2B) 。而,Twist1过表达时Cul2基因mRNA和蛋白质的表达量下调,而敲低Twist1时Cul2基因mRNA和蛋白质的表达量上调(Figure 2C, 2D) 。另外,我们确信内源性的circ-10720是由Cul2基因产生的,Cul2位于10号染色体,circ-10720由第6-12个外显子构成(Figure 2E) ,circ-10720在过表达的Twist1 PLC细胞中上调表达,在敲低Twist1 SMMC-7721中下调表达。
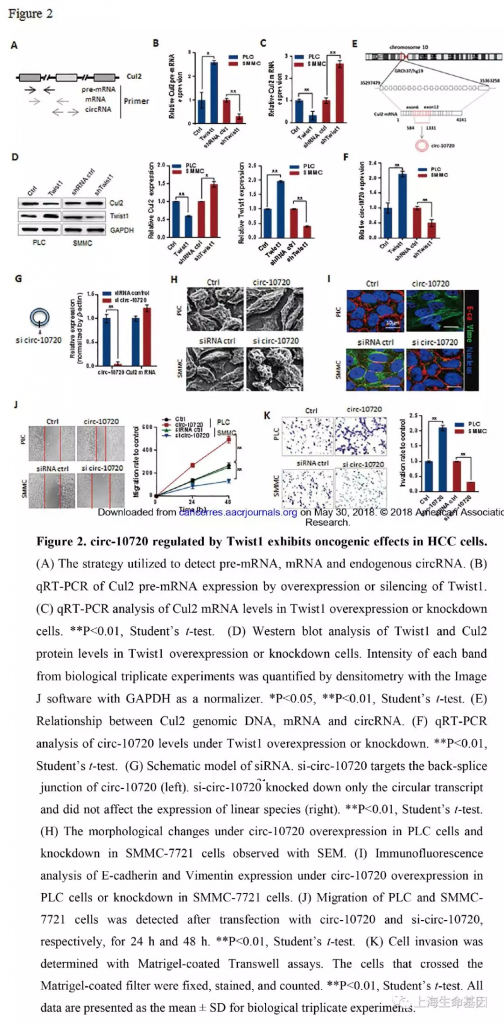
为了研究circ-10720的功能,我们针对反向剪接序列设计了siRNA(Figure 2G, left) 。我们发现siRNA只会下调环状RNA转录本,而不会影响线性形式(Figure 2G, right) 。SEM观察circ-10720过表达对细胞形态的影响,细胞伪足增加而且细胞形态变成间叶细胞样的,当circ-10720敲低时,细胞变成上皮样(Figure 2H) 。免疫荧光分析circ-10720过表达和敲低EMT markers。结果显示circ-10720过表达时E-cadherin表达量下降,Vimentin表达量上升,在敲低的circ-10720时结果相反(Figure 2I) 。另外,发现circ-10720可以促进PLC细胞增殖迁移和侵袭(Figure 2J, 2K) 。总之,Twist1可以促进circ-10720表达,而circ-10720可以促进癌进展。
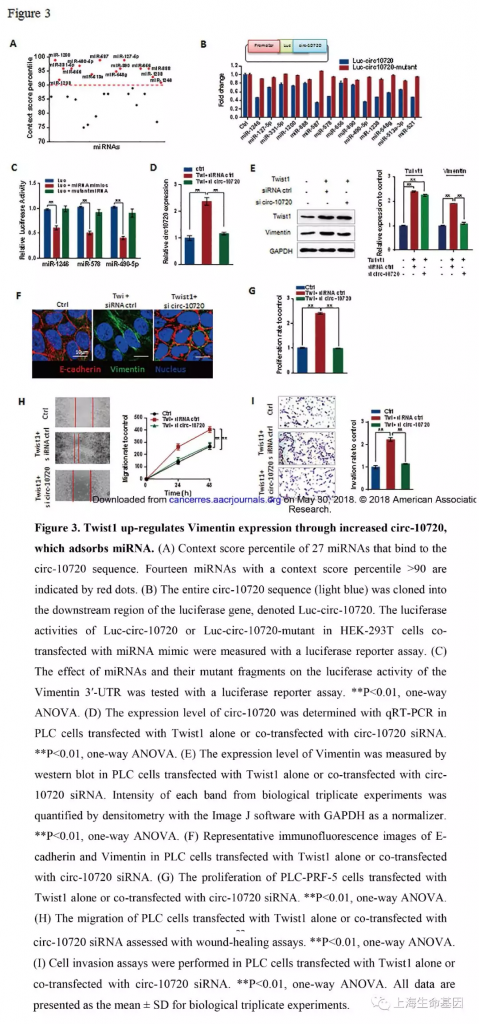
3、 Twist1通过增加circ-10720的表达,进而上调Vimentin的表达,circ-10720可以海绵吸附miRNA
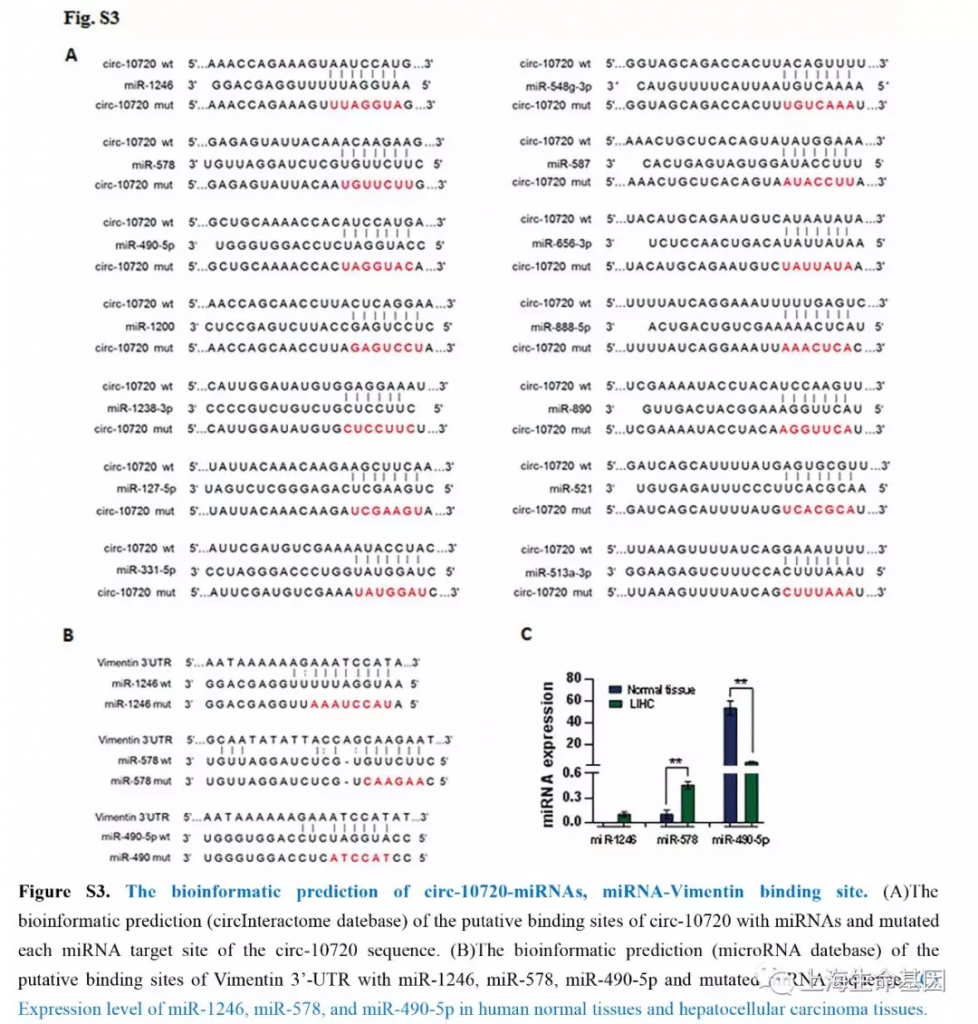
为了鉴定circ-10720结合的miRNA,我们使用CircInteractome数据库预测miRNA。27个miRNAs中有14个(miR-1246, miR-127-5p, miR-331-5p, miR-1200, miR-888, miR-587, miR-578, miR-656, miR-890, miR-490-5p, miR-1238, miR-548g, miR-513a-3p, and miR-521) 得分值超过90(Figure 3A) 。我们使用荧光素酶报告系统验证miRNAs与circ-10720的结合及位点突变时关系(Supplementary Figure S3A) ,我们发现转染miRNAs在结合位点突变时并没有影响荧光的强度(Figure 3B) 。结果说明,circ-10720可能作为miRNAs海绵吸附发挥作用。其中miR-1246, miR-578 and miR-490-5p 预测可以与Vimentin结合(Supplementary Figure S3B) 。另外,我们也分析了miRNAs在肝正常样品和肝癌样品中的表达量(Supplementary Figure S3C) 。miR-1246, miR-578 and miR-490-5p确实在肝癌中表达。miR-490-5p的表达量高于miR-1246, miR-578。荧光素酶报告基因分析miRNAs会抑制Vimentin 3′-UTR荧光素酶活性,而突变的miRNA模拟物没有这个影响。miR-490-5p的抑制作用强于miR-1246, miR-578。因此,miR-490-5p可能是主要miRNA调控Vimentin的表达。
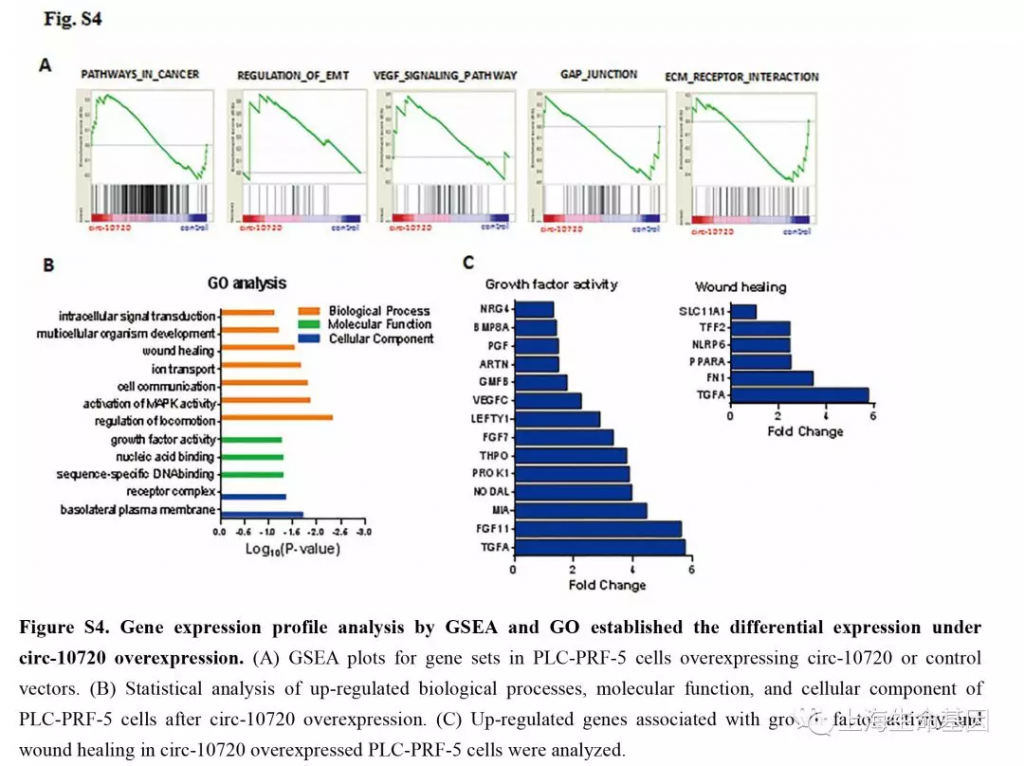
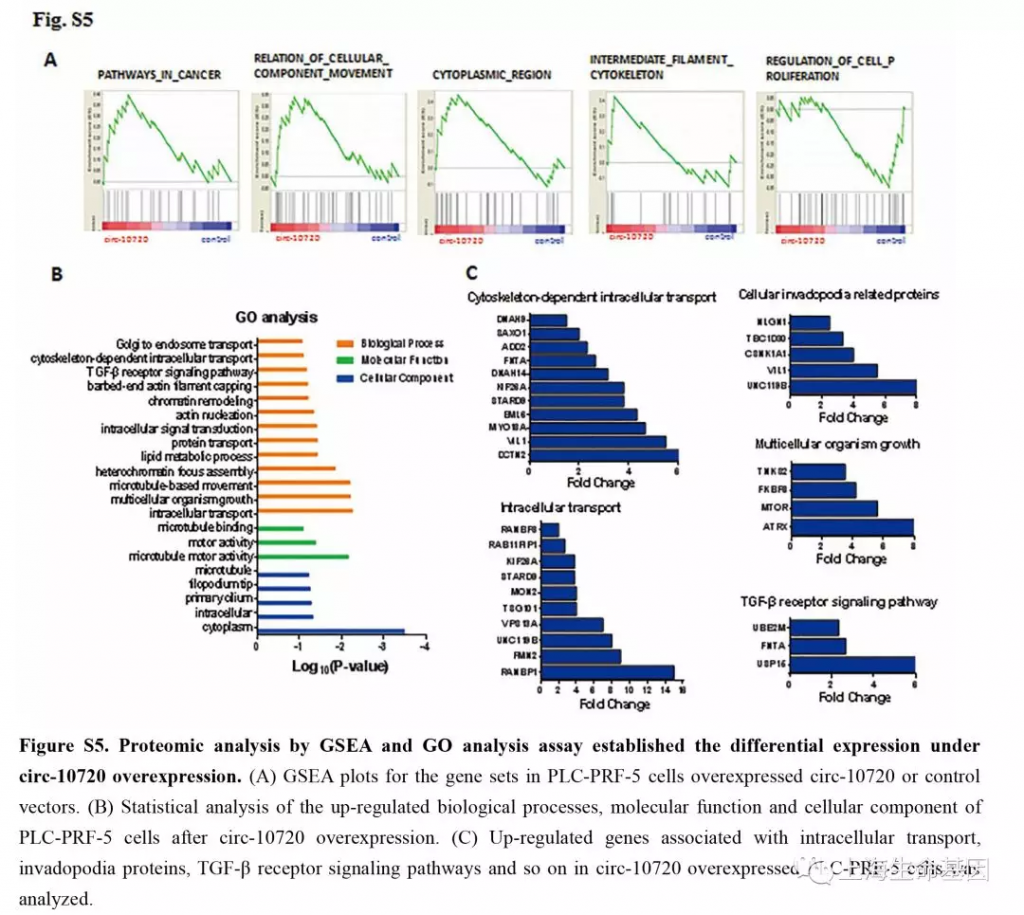
为了验证circ-10720吸附可以调控Vimentin的miRNAs,我们对过表达的circ-10720细胞进行基因表达谱和蛋白质谱研究。并对差异基因进行GSEA富集分析。GO富集分析差异基因涉及到的生物学过程,分子功能和细胞组分。如Figure S4A,过表达circ-10720影响的差异基因涉及到cancer, EMT and VEGF signaling pathways,并且cell adhesion related pathways相关通路下调。GO分析中,intracellular signal introduction, wound healing, growth factor activity (Supplementary Figure S4B) 等上调。上调基因如Supplementary Figure S4C。蛋白质谱实验的结果与基因表达谱的结果相似,GSEA分析(Supplementary Figure S5A) and GO analysis (Supplementary figure S5B) 。与ntracellular transport, cellular invadopodia-related proteins, multicellular organism growth, TGF-β receptor signaling pathways 等相关的上调基因如Supplementary Figure S5C。
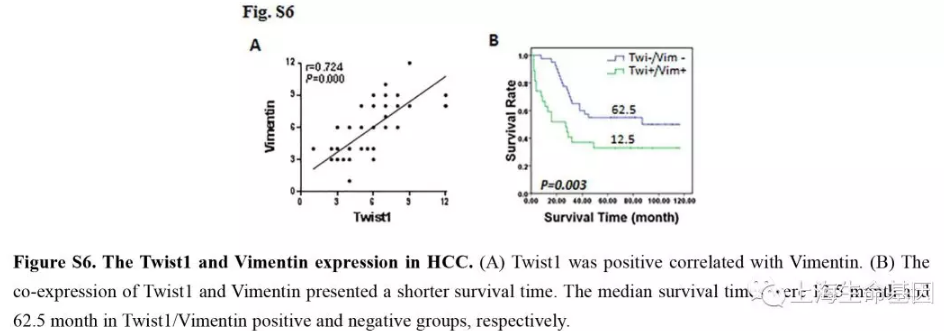
为了证明 Twist1介导Vimentin的调控是通过circRNA发生的,我们进行loss-of-function实验。PLC细胞过表达时circ-10720的表达量显著增加,进一步敲低circ-10720抵消circ-10720的增长(Figure 3D) 。肝癌样品中 Twist1与Vimentin的表达呈现正相关,同时表达时病人更短的生存时间(Supplementary Figure S6A-B) 。Western blotting结果显示Twist1可以提高Vimentin的表达水平,而过表达Twist1的PLC细胞,敲低circ-10720会影响Twist1对Vimentin的正调控表达(Figure 3E) 。免疫荧光分析过表达Twist1显示E-cadherin表达量明显下降而Vimentin的表达水平明显上升,过表达Twist1细胞敲低circ-10720时会影响Twist1对E-cadherin和Vimentin表达调控。而且敲低circ-10720会抵消过表达Twist1引起的细胞增殖(Figure 3G) ,迁移(Figure 3H) ,和侵袭(Figure 3I)。上述结果显示Twist1是通过circ-10720吸附miRNAs调控Vimentin的表达,进而促进肝癌进展的。
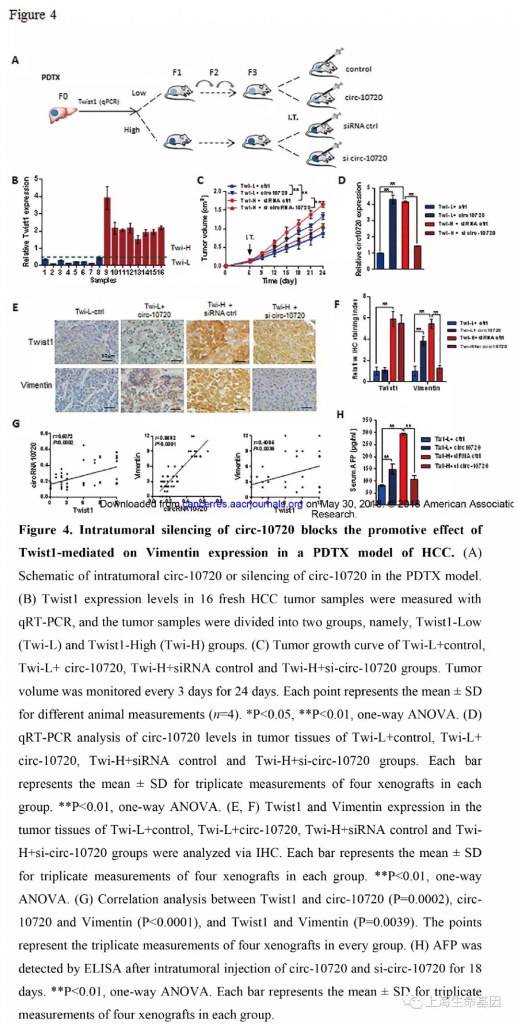
4 、肝癌PDTX模型瘤内沉默circ-10720阻碍Twist1介导的Vimentin表达
为了研究体内Twist1通过circ-10720调控Vimentin表达及circ-10720体内功能,我们建立了PDTX模型(Figure 4A) 。首先qPCR检测肝癌病人肿瘤组织Twist1表达量,而后将组织分为两组Twist1-Low and Twist-High组 (Figure 4B) ,Twist1-Low组一半瘤内注射circ-10720慢病毒,Twist-High组一半瘤内注射si-circ-10720。高表达的Twist可以显著促进肿瘤的生长。Twist-Low组过表达circ-10720可以增加肿瘤体积。而Twist-High组敲低circ-10720可以阻碍Twist促进癌生长的功能(Figure 4C) 。qPCR检测Twist1-Low+control, Twist1-Low+circ-10720, TwistHigh+siRNA control, and Twist-High+si-circ-10720 groups circ-10720的表达量。结果显示circ-10720在Twist1-Low+circ-10720 and Twist-High+siRNA组表达量高。敲低circ-10720可以抵消Twist1-High促进肿瘤的功能(Figure 4D) 。高表达Twist1可显著增加Vimentin表达,而敲低circ-10720减少Twist1促进Vimentin作用。过表达circ-10720可以增加Vimentin的表达。敲低Twist-High组circ-10720和过表达Twist1-Low组circ-10720对Twist1的表达水平影响很小(Figure 4E, 4F) 。而且,我们分析了肿瘤中Twist1, Vimentin 和 circ-10720 的相关性。结果显示三者的表达量呈现正相关(Figure 4G) 。血清AFP表达量与circ-10720 表达量一致。因此这些结果说明circ-10720 可以促进肿瘤生长和Vimentin表达;体内肝癌敲低circ-10720可以阻碍Twist1对Vimentin表达促进作用。
5、 DEN诱导的TetOn-Twist1小鼠肝癌模型沉默circ-10720可抑制Twist1诱导的肿瘤转移
为了研究敲低circ-10720对Twist1引起的肿瘤转移的影响,我们建立DEN诱导的TetOn-Twist1转基因小鼠肝癌模型。为了产生肝癌,TetOn-Twist1小鼠使用DEN处理产生肿瘤,接下来每两周注射TCPOBOP促进肿瘤生长。处理结束后,将产生肝癌的小鼠自由分成两组,一组喂无doxycycline水,第二组喂有doxycycline水(Twis1t group) ,促进Twist1表达。7天后,Twist1 group组一半的小鼠静脉注射si-circ-10720(Twi + si-circ-10720 group),另一半静脉注射siRNA对照(Twi + siRNA ctrl group) (Figure 5A) 。人类Cul2基因位于10号染色体,而小鼠Cul2基因位于18号染色体,blast分析发现人与小鼠Cul2基因mRNA有91%的相似度。人circ-10720由6-12外显子组成,小鼠Cul2基因6-12外显子与人类的高度相似,尤其是人与小鼠的6和12外显子的反向剪切位点。人与小鼠6和12号外显子分别有89% and 93%的相似性。因此小鼠的6-12外显子也可能形成circRNA(Supplementary Figure S7A)。人与小鼠circ-10720的相似度是91% (Supplementary Figure S7B) 。在两个circRNAs的反向连接处发现32个相同的碱基。因此人类的si-circ-10720同样适合小鼠。
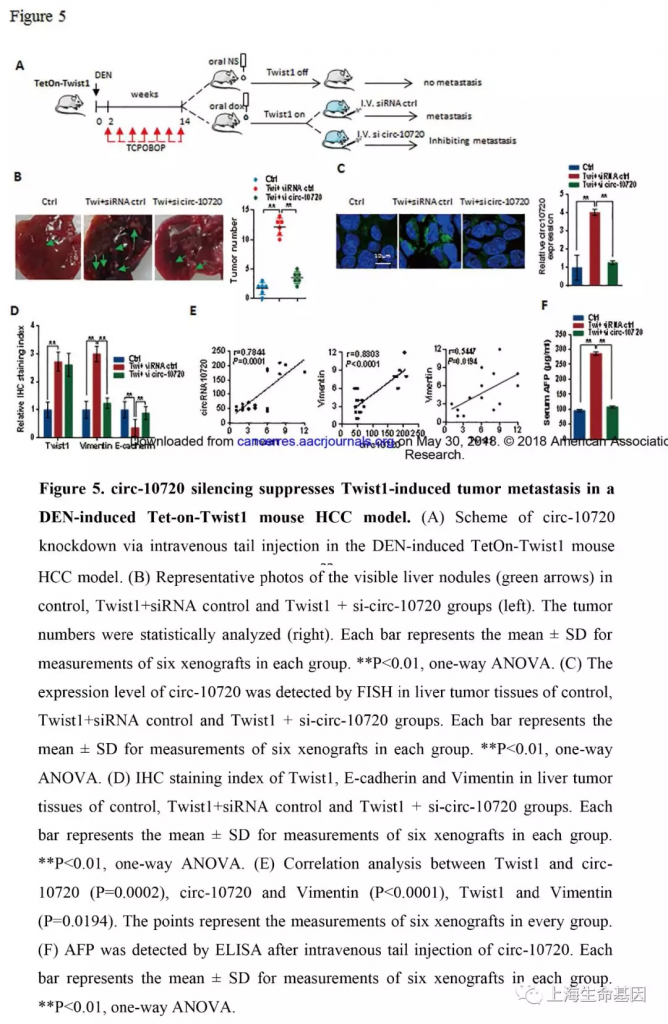

TetOn-Twist1小鼠肝癌模型,检测小鼠肝产生瘤的数量。结果显示doxycycline处理的小鼠肿瘤数量显著上升,而注射si-circ-10720的小鼠则显示抵消的结果(Figure 5B) 。而且,我们使用FISH检测了circ-10720的表达水平。结果显示Twi + siRNA ctrl 组表达量增加而Twi + si-circ-10720组表达量下降(Figure 5C) 。Twi + siRNA ctrl 组肝肿瘤组织中Twist1 and Vimentin的表达量上升,而Twi + si-circ-10720 组敲低circ-10720则阻碍Twist1对Vimentin的影响。E-cadherin的表达与Vimentin的表达相反(Figure 5D) 。而且我们分析了肝肿瘤中Twist1, Vimentin and circ-10720表达相关性。结果显示三者呈正相关(Figure 5E) 。血清AFP表达水平与circ-10720 in control, Twi + siRNA ctrl, and Twi + si-circ-10720一致(Figure 5F) 。数据显示DEN-doxycycline诱导的小鼠肝癌模型中敲低circ-10720可以抑制Twist1对肿瘤生长,转移和Vimentin表达的促进效应。
6、 circ-10720作为肝癌分子标志物
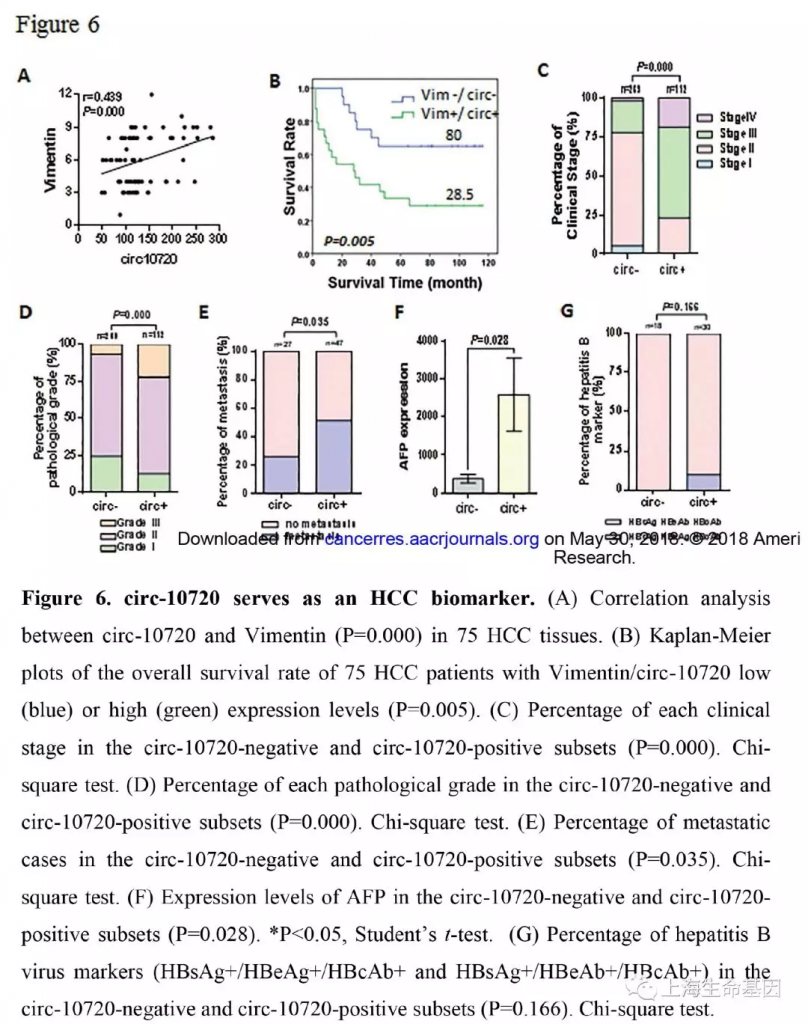
为了了解更多circ-10720在肝癌发生发展中的作用,拓宽其在临床病理学中的作用。我们收集了388例肝癌样品,使用FISH分析了circ-10720的表达水平。对circ-10720和Vimentin的表达水平相关性分析发现,二者呈正相关(r=0.439, P=0.000) (Figure 6A) 。Kaplan-Meier分析显示circ-10720/Vimentin的表达与75例病人更短的生存期有关。生存期中值由80个月下降到28.5月(Figure 6B) 。而且,我们分析了circ-10720表达水平和肝癌临床分期病理分级的关系。临床分期I-II,77.7%的病人circ-10720低表达,23.2%的高表达。而III-IV则分别是22.3% and 76.8%(P=0.000) (Figure 6C) 。circ-10720低表达和高表达组中病理分级III分别占6.7% 和22.3%(P=0.004)(Figure 6D) 。circ-10720低表达和高表达组中转移的比例分别是25.9%和 51.1%(P=0.035) (Figure 6E) 。而且对两组的AFP表达水平也进行了检测。circ-10720高表达组AFP表达水平显著高于circ-10720低表达组(Figure 6F) 。circ-10720表达水平与hepatitis B markers的表达水平并不一致(Figure 6G) 。这些发现说明circ-10720与肿瘤进展和不良预后有关,circ-10720可以作为肝癌分子标志物,除了hepatitis B病人中。
5、 讨论
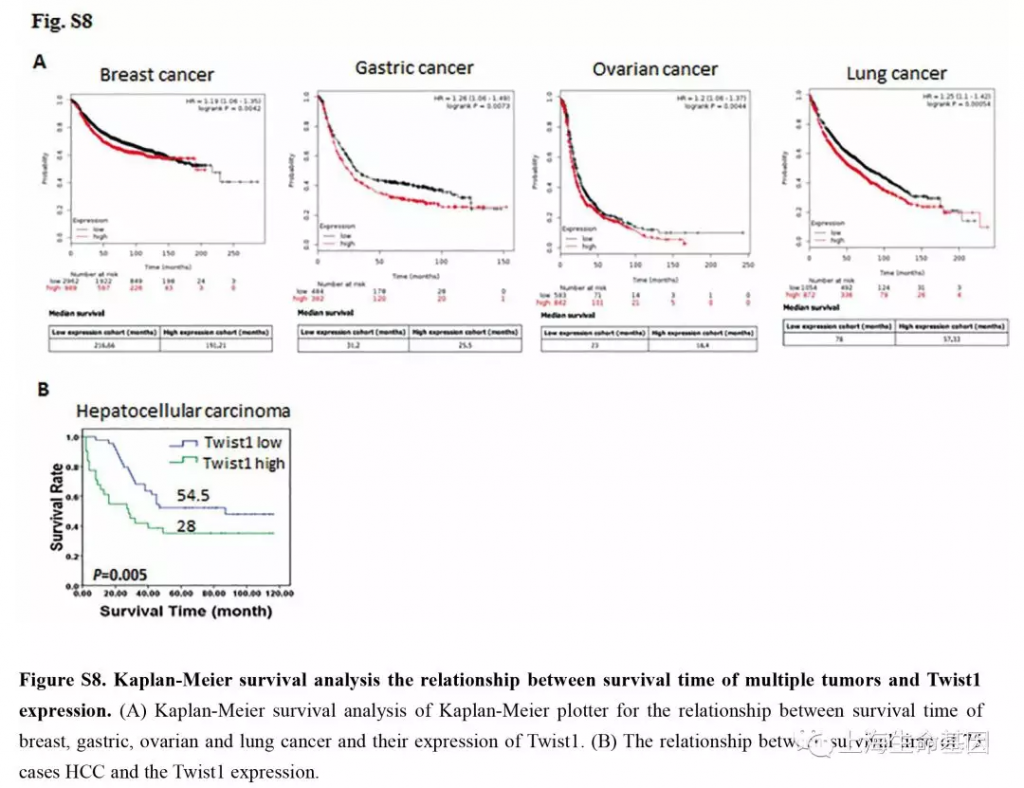
肝癌中Twist1在EMT过程中促进肿瘤转移和血管生成的作用已经有研究过。高表达的Twist1在多种肿瘤中与更短的生存时间相关,如心脏,胃,卵巢和肺等癌(Kaplan-Meier plotter database, Supplementary Figure S8A),以及肝癌(Supplementary Figure S8B) 。本研究,ChIP-seq结果显示Twist1可以结合Cul2基因启动子区,荧光素报告系统验证Twist1可以促进Cul2基因启动子区活性。我们发现在Twist1过表达肝癌细胞中,Cul2前体mRNA表达量升高而其mRNA和蛋白的表达量下降。因此,Twist1可以促进Cul2的转录而非翻译。Cul2是一个抑癌蛋白,因为其与von Hippel-Lindau (VHL) 基因有关,并与泛素化HIFα降解有关。但也有报道,Cul2是正常的血管生成所需要的,并与细胞周期调控有关,可以促进胃癌的发展。本研究,我们分析了75例肝癌组织,发现Cul2基因的表达水平与肝癌转移没有显著相关性。因此,我们推断Twist1可能影响Cul2 circRNA表达和功能。
近期,发现circRNAs是由通过非常规的剪接方式形成。人们发现许多癌中各种各样的circRNAs发挥着竞争性内源RNA的功能。有趣的是一个基因可以通过可变的反向连接点形成多种circRNAs。而且circRNAs相比于线性RNAs更偏好某些外显子。本研究,我们发现外源表达的Twist1可以促进Cul2的转录和Cul2相关circRNAs的形成。circ-10720与不良预后相关,可以促进肝癌转移和发展。一系列证据说明,Twist激活及Twist诱导Cul2 circRNAs是EMT过程中极为重要的。
肿瘤细胞转移涉及到一系列的生物学过程,肿瘤细胞能够克服正常组织设置的多种障碍。Vimentin是间质细胞标志物,可以维持细胞形态和细胞骨架。他可以调动多种涉及细胞粘附和迁移的蛋白。尽管人癌细胞中,Vimentin可以受到Twist1的诱导,但其具体的机制尚不清楚。本研究我们发现Twist1通过间接的通路介导circ-10720吸附miRNA调控Vimentin的表达。确实,我们的结果显示Twist1引起circ-10720上调,吸附可以作用于Vimentin的miRNAs,引起Vimentin转录后水平的升高。敲低circ-10720可抑制Twist1对Vimentin调控的影响。在PDTX and DEN-induced TetOn-Twist肝癌小鼠模型中,小鼠经瘤内或静脉注射si-circ-10720。结果显示,沉默的circ-10720可以阻碍Twist1对Vimentin的促进作用,并影响肝癌细胞恶化和转移。这些结果说明Vimentin受到Twist1间接的调控,暗示了circRNA在EMT过程中的重要作用。
在体内和体外实验,我们均检测了circ-10720在促进肿瘤生长和转移中的作用。使用基因表达谱和蛋白质谱确认circ-10720上调基因与肿瘤的进展有关。组织样品病理学分析显示circ-10720与不良预后和肿瘤进展有关,并可以作为潜在分子标志物。
尽管,本研究EMT转化中癌基因circ-10720可以介导Twist1对Vimentin的调控,我们没有研究Twist1调控Cul2 RNA可变剪接的机制,不了解是否有其他转录因子参与这个过程。因此,Twist1是如何调控Cul2 RNA的机制仍有待研究。
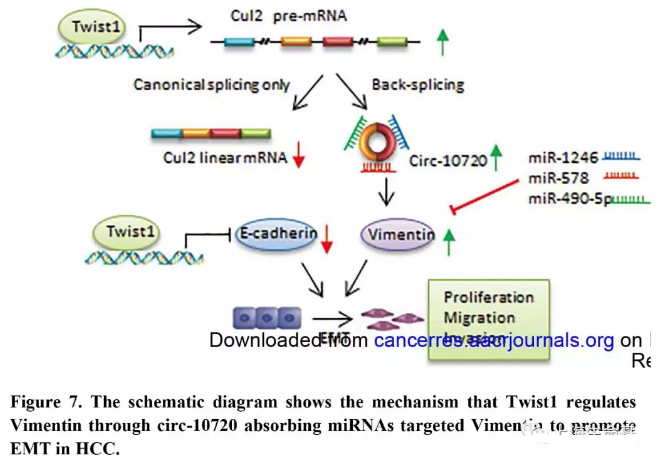
总之,我们揭示了Twist1调控Vimentin的机制。Twist1可以结合到Cul2的启动子区,并促进Cul2环状RNA的表达,进而通过吸附Vimentin目标miRNAs促进Vimentin表达(Figure 7) 。circ-10720也能够促进EMT过程,肿瘤转移和恶化。而且circ-10720的表达与Twist1和Vimentin的表达呈正相关。数据显示circ-10720介导Twist1调控Vimentin,并在EMT过程中发挥重要作用。这些发现对于恶性肿瘤开发基于circRNA的诊断和治疗有帮助。





来第一个抢占沙发评论吧!