|
Circular RNAs are differentially expressed in liver ischemia/reperfusion injury model
小鼠肝缺血/再灌注损伤模型circRNAs表达谱分析
期刊:JOURNAL OF CELLULAR BIOCHEMISTRY 影响因子:3.085
单位中山大学附属第三医院
1 摘要:
肝缺血/再灌注Liver ischemia/reperfusion (I/R)病人由于引发强烈的炎症反应具有很高的死亡率。然而I/R损伤的病理机制并不清楚。近期研究显示circular RNAs在多种人类疾病中发挥重要作用。本研究通过血检及hematoxylin-eosin(HE)染色确诊I/R损伤发生。提取样品total RNA用于RNAseq扫描差异表达的circRNAs,而后使用qPCR验证。并对差异表达的circRNAs做了GO,KEGG富集分析以推断其功能。凝胶电泳和RNase R处理验证circRNAs的成环结构。生信分析发现I/R损伤小鼠模型中有一些circRNAs发生了差异表达。GO分析了其在生物学过程,细胞组分,分子功能三个方面的作用。同时,KEGG富集发现Hippo signaling pathway与I/R损伤模型相关。为了确认RNAseq数据准确性,对2上调,3下调circRNAs使用琼脂糖凝胶和RNase R处理的方式进行了验证。简而言之,本研究对研究I/R损伤提供了新的角度,新的和潜在高效的靶标。
2 材料方法
2.1 I/R损伤小鼠模型
所有动物实验已获得中山大学伦理委员会的批准。I/R损伤小鼠模型根据之前报道的方法进行。C57BL/6小鼠,年龄8-10周,术前饥饿处理24小时,可以饮水。腹膜注射80 mg/kg ketamine (Nembutal, St. Louis, MO)对其麻醉。实验组与对照组均包含5只。每个小鼠进行中线剖腹探查。金属微脉管夹吸取流到左侧和中侧肝页血液60min,引起肝缺血。松开微脉管夹6h,再将血液灌注回去。缝合腹腔。对照组打开腹腔暴露肝页不做任何操作。动物温控设备控制体温。灌注完之后收集麻醉小鼠的血液制备血清。获得血液后,杀掉小鼠,获取缺血肝,液氮速冻,-80℃保存用于后续实验。
2.2 生化分析
商业试剂盒检测血清转氨酶ALT and AST活性。ALT activity assay kit (ab105134, Abcam, Cambridge, MA)检测alanine transaminase (ALT)活性。血清加入到含有反应液的微孔板中。微孔板读取仪(Biotek, Winooski, VT)读取570nm处光密度。AST activity assay kit (MAK055, Sigma, St. Louis, MO)检测Aspartate aminotransferase (AST)活性。与反应液37°C孵育2-3分钟。每5分钟测量其在450nm处吸收值,直到大部分样品的值高于最大值标准。计算ΔA450,基于ΔA450与反应时间的比值计算AST活性。
2.3 酶联免疫分析(ELISA)
提取肝 I/R损伤小鼠模型动脉血。ELISA法计算血清IL-1β and TNF-α密度。包被后用PBST缓冲液清洗,1% BSA封闭37℃孵育1h。然后加入anti-IL-1β or TNF-α抗体和辣根过氧化物抗体37℃孵育1h。加入发色底物3,3′,5,5′-Tetramethylbenzidine后检测。EnSpire multimode plate reader (Perkin Elmer, Waltham, MA) 450nm读取吸收峰。
2.4 HE染色
肝脏切片二甲苯脱蜡,酒精脱水。然后苏木紫染色8分钟,浸入0.2%氨水或浸入碳酸锂溶液1min。浸完95%酒精后,切片伊红-荧光桃红复染1分钟。最后二甲苯固定。Nikon microscope (ECLIPSE 90i, Nikon, Tokyo, Japan)拍照。
2.5 RNAseq
RNeasy Mini Kit (QIAGEN, Germany)提取样品total RNA。Agilent bioanalyzer 2100 (Agilent, Santa Clara,CA)评估样品完整性。RNA Clean XP Kit (Beckman Coulter, Carlsbad, CA) and RNase-free DNase Set (QIAGEN)纯化RNA。NanoDrop 2000 (Thermo Fisher, Waltham, MA)计算RNA质量和密度。为了进行circRNA测序,RNase R (Epicenter, Madison, WI)消化线性RNA。1ug的RNA使用VAHTSTM mRNA-seq v2 library Prep Kit for illumina构建文库。对于mRNA测序,磁珠选择含有polyA尾的mRNA。RNA片段化并合成双链。末端修复并添加A。连接测序接头。而后,进行PCR扩增。Agilent bioanalyzer 2100检测文库质量。Illumina Hiseq 4000上机测序。R软件进行后续表达量归一化及数据分析。差异表达的circRNAs或mRNA选择条件为q-value < 0.05 and fold change > 2.0。
2.6 RT-PCR
TRIzol reagent (Life Technologies, Carlsbad, CA)提取total RNA。2ug的total RNA进行反转录。使用one-step RT-PCR kit合成cDNA。反应液37℃孵育15分钟。85℃ 15分钟终止反应。SYBR Green (Toyobo, Osaka, Japan),ABI 7300 real-time PCR thermal cycle instrument (ABI, Waltham, MA)实时定量。反应系统包括混合液,引物,cDNA模板。ΔΔCt法计算基因相对表达量。
2.7 GO富集分析
GO下载于GO consortium (http://www.geneontology.org/),GO注释基于NCBI LocusLink (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db = gene)。对差异表达的circRNAs进行GO归类,包括分子功能,细胞组分,生物学过程三部分。差异表达基因的富集分析使用(DAVID) 6.7 web server (https://david.ncifcrf.gov),参数默认。
2.8 KEGG富集分析
KOBAS 2.0分析KEGG通路。Benjamini and Hochberg's方法对p值校正,adjusted P-value < 0.05认为有统计学意义。
2.9 统计分析
数据呈现形式为mean ± SEM。Unpaired Student's t-tests差异分析。P-value < 0.05认为有显著性差异。
3 结果
3.1 建立小鼠I/R损伤模型
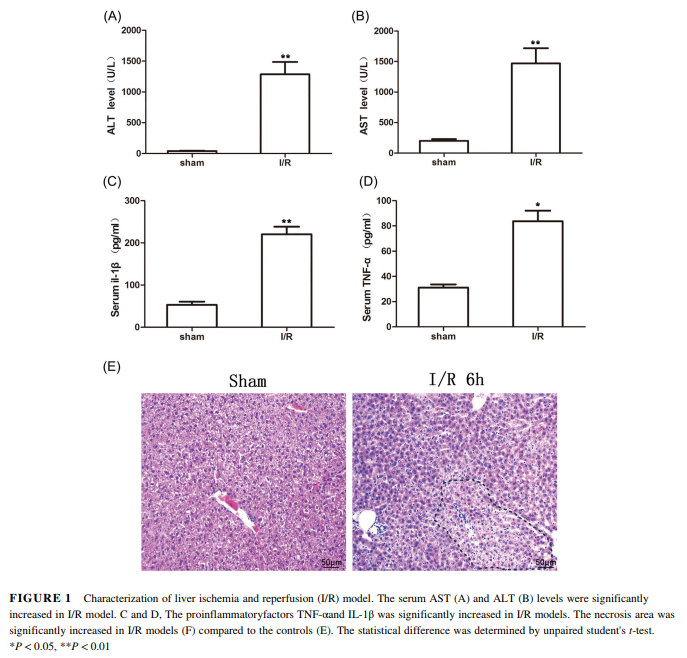
为了确定小鼠I/R损伤模型是否成功,我们首先检测了血清AST and ALT表达量。数据显示其表达量相对于对照组织显著增加(Figures 1A and 1B, P < 0.01)。然后,我们对炎症因子进行定量。ELISA数据显示TNF-α (P < 0.05) and IL-1β (P < 0.01)密度均显著增加(Figures 1C and 1D)。结果说明小鼠I/R损伤肝炎症上升。而且HE染色评估I/R损伤肝坏死。我们发现相比于对照组织,模型坏死区明显变大。坏死区为实线区(Figure 1E)。各种数据说明,小鼠I/R损伤模型已成功建立。
3.2 生物信息学分析小鼠I/R损伤模型差异表达的circRNAs
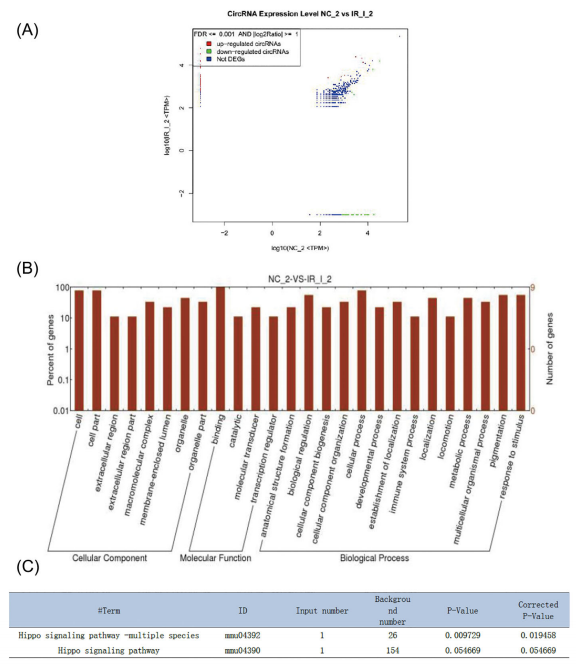
RNAseq指出小鼠I/R损伤模型中差异表达的circRNAs(Figure 2A)。GO分析指出差异表达circRNAs关联的生物学过程,细胞组分,分子功能(Figure 2B),GO富集列表在补充材料中。KEGG分析显示Hippo signaling pathway或许是引起circRNAs差异表达的一个重要因素(Figure 2C)。
3.3 小鼠I/R损伤模型差异表达的circRNAs验证
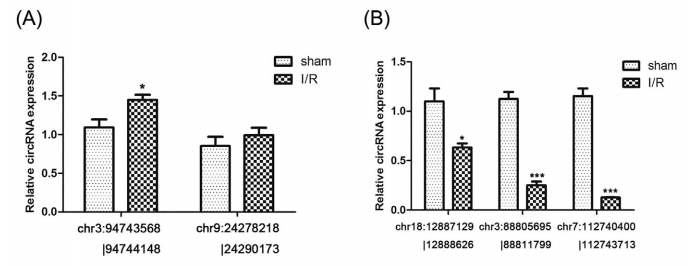
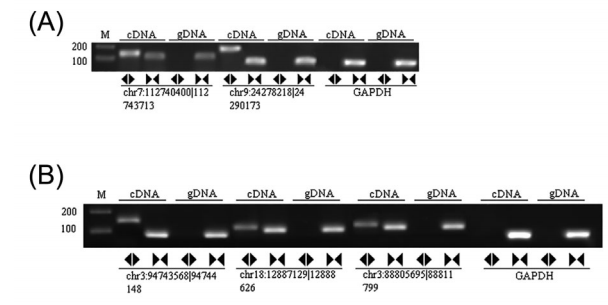
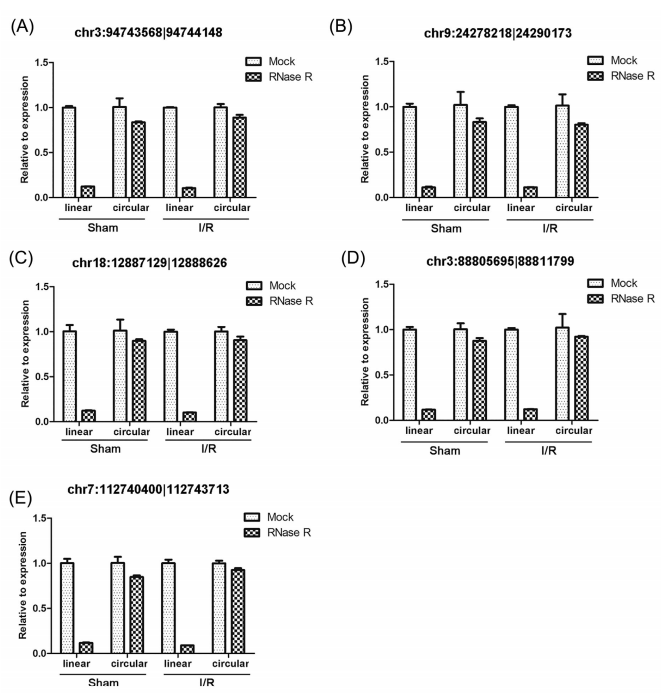
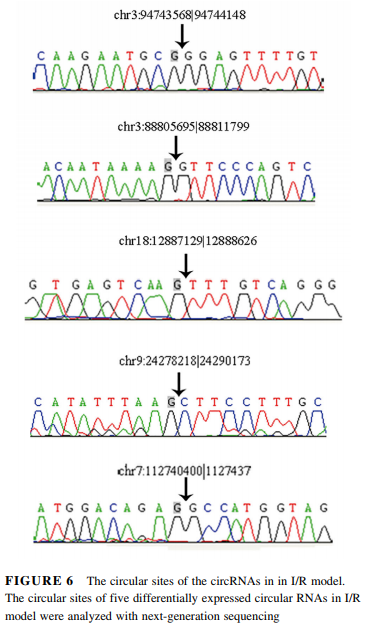
我们使用RT-PCR验证差异表达的circRNAs。根据RNAseq数据,我们选择5个差异表达最明显的circRNAs,包括两个上调的chr9:24278218|24290173 and chr3:94743568|94744148,以及三个下调的chr7:112740400|112743713, chr18:12887129|12888626, and chr3:88805695|88811799 (Table 1)。qPCR显示chr3:94743568|94744148的表达水平显著增加(P < 0.05),而chr9:24278218|24290173的水平没有显著改变(Figure 3A)。而且,chr7:112740400|112743713 (P < 0.001), chr18:12887129|12888626 (P < 0.05) and chr3:88805695|88811799(P < 0.001)均显著降低(Figure 3B)。接下来我们验证了上述5个circRNAs成环的可能性。RT-PCR显示均具有成环的特性,GAPDH作为对照(Figures 4A and 4B)。成环也经过RNase R消化实验验证(Figure 5A-E)。消化之后,线性RNA显著下降,而circRNAs没有显著变化(Figure 5A-E)。最后对PCR产物Sanger测序验证环化位点(Figure 6)。因此,我们可以确信,小鼠肝I/R损伤模型确实有一些circRNAs发生了差异表达。

4 讨论
本研究,我们发现小鼠肝I/R损伤模型中有一些circRNAs发生了差异表达,并通过生物信息学分析预测了他们的功能。本研究为未来治疗肝I/R损伤提供了一些新的可能。
其他研究中证明建立鼠肝I/R损伤模型流程是有效的。本研究我们也使用三种方法证明肝I/R损伤模型的建立是成功的。三种方法包括AST/ALT水平,炎症因子检测和坏死检测,这些方法广泛运用评估I/R损伤模型。首先,天门冬氨酸盐转移酶能够催化天门冬氨酸盐,a-酮戊二酸成草酰乙酸盐和谷氨酸盐。而ALT可以催化L-丙氨酸成α-酮戊二酸。这两种酶在医学上常用于诊断肝损伤和肝中毒。此处两种国美表达量升高,表明肝组织损伤。第二,肝I/R损伤模型炎症因子的密度升高。与之前报道的一致,即IL-1β可以驱动I/R损伤模型炎症。第三,I/R损伤模型坏死严重。对肝I/R损伤模型坏死的机制了解很少,显示关键的坏死分子在坏死区域并没有显著增加。考虑到I/R损伤引起的凋亡,坏死也是I/R损伤一个很好的指示因子。因此可以看出我们建立的I/R损伤比以往的建立的更好。
通过生物信息分析,我们发现一些circRNAs在I/R损伤模型中有差异表达。然而这些circRNAs的功能机制并不清楚。根据之前在别的疾病上的报道,circRNAs在I/R损伤的功能可能有以下几种。首先是circRNA-miRNA方面,circRNAs可以调控miRNAs的功能进而在转录调控中发挥重要作用。circRNAs与miRNAs的关系以及协作功能在其他人类疾病中广泛研究,可以影响调控,血管形成,侵袭,代谢等。因此,可能是circRNAs-miRNAs关系调控肝损伤进程,差异表达的circRNAs吸附的miRNAs有待后续进一步确定。第二,circRNAs可能调控了几个重要的信号通路进而影响I/R损伤。在癌发展时,circRNAs可以调控几种重要的信号通路如wnt/beta-catenin, p21-CDK2, and Cyclin A, p-CDK2 pathway。然而依然不清楚circRNAs是如何影响肝I/R损伤的,推测是某些信号通路调控了此过程,这需要进一步研究。第三,circRNAs调控细胞动态。Hirschsprung's disease中circRNAs可以调控细胞的迁移和增殖。而且circRNA-Foxo3可以促进癌细胞凋亡。因此,这可能是circRNAs的一个机制,即肝I/R损伤后能够影响细胞凋亡和增殖。以上几点是以后工作的方向。
综上,本研究我们在肝I/R损伤模型中发现了一些差异表达的circRNAs。对其环状特性进行了验证。因此,这些circRNAs或许可以作为肝I/R损伤新的治疗靶点。这些circRNAs在肝I/R损伤的出现,发展的功能需要未来进一步研究。
5 研究思路
材料:
实验组与对照组均包含5只,RNAseq测序数量不详。
方法:
1 建立模型
肝I/R损伤建立,生化分析,酶联免疫分析,HE染色。
2 RNAseq 去线性处理,链特异性建库,具体分析流程不详。
3 qPCR 验证。
4 GO富集分析使用(http://www.geneontology.org/),(DAVID) 6.7 web server (https://david.ncifcrf.gov),KEGG分析使用KOBAS 2.0。
备注:前面实验方法提到了用polyA建库测序获取mRNA信息,也提到DAVID进行GO富集分析,但后续结果,讨论中均没有提及。circRNAs整体特征,circRNAs差异的数量多少,上下调多少,均没有提及,缺乏重要信息,怀疑RNAseq没有获得较好的结果。





来第一个抢占沙发评论吧!