原创作者|百迈客生物
前面我们已经初步介绍了研究热点方向:肿瘤微环境,无独有偶,最近发表在oncogene杂志中这篇文章恰是肿瘤微环境方向,且涉及了肿瘤微环境的基质细胞(MDSC)、生理因素(缺氧)和亚细胞原件(外泌体),下面小编将和大家分享一下这篇文献。

研究背景
髓系细胞的分化和功能异常是癌症的标志,髓系来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)在癌症发展期间扩增并具有有效的免疫抑制功能以抑制T细胞的活化。MDSC通过促进肿瘤细胞存活、血管生成、侵袭和转移在肿瘤进展中发挥重要作用。MDSC在小鼠中以细胞表面标志物Ly-6C / G和CD11b为特征(CD11b+Gr-1+),而在人体中则为CD11b+CD33+HLA-DR-。切除原发性肿瘤可导致小鼠MDSC全身性减少,暗示MDSC扩增与肿瘤为因果关系。目前,MDSC发育和激活的机制尚未明确定义。
外泌体是存在于所有体液中的小囊泡(直径50-150nm),且正常细胞和恶性细胞均可分泌。据报道,肿瘤外泌体携带能够在体外和体内抑制免疫细胞功能,并诱导MDSC活化和扩增的遗传物质和蛋白质。miRNA表达异常可能是MDSC扩增和积累的基础。肿瘤来源的外泌体已被证明能够将miRNA递送至免疫细胞并影响其分化和功能。
胶质母细胞瘤在胶质瘤中是最常见的类型,几近占所有脑肿瘤的1/2。包括MDSC在内的胶质母细胞瘤的复杂免疫微环境减弱了目前治疗方法的疗效。缺氧是快速增长的胶质母细胞瘤肿瘤组织公认的特征。据报道缺氧可影响外泌体的释放和miRNA含量,并在MDSC分化和积累中发挥重要作用。同时,已报道胶质母细胞瘤衍生的外泌体调节其受体成纤维细胞和肿瘤相关巨噬细胞的mRNA表达谱。缺氧是否影响胶质母细胞瘤来源外泌体的组分以及进一步增加MDSC的扩增和免疫抑制功能是未知的。
研究材料
1)胶质瘤细胞系:
3种传代细胞系:人神经胶质瘤细胞系U87、小鼠神经胶质瘤细胞系GL261和G422
1种从人类胶质母细胞瘤组织分离培养的原代细胞系:P3细胞系
2)从上述几种胶质瘤细胞系的培养基(添加10%无外泌体胎牛血清FBS)中分离外泌体(glioma-derived exosomes,GDEs),设置2组培养条件:常氧条件和缺氧条件,分离得到的外泌体分别为N-GDEs和H-GDEs。
研究路线

研究结果
1、N-GDEs和H-GDEs分离鉴定
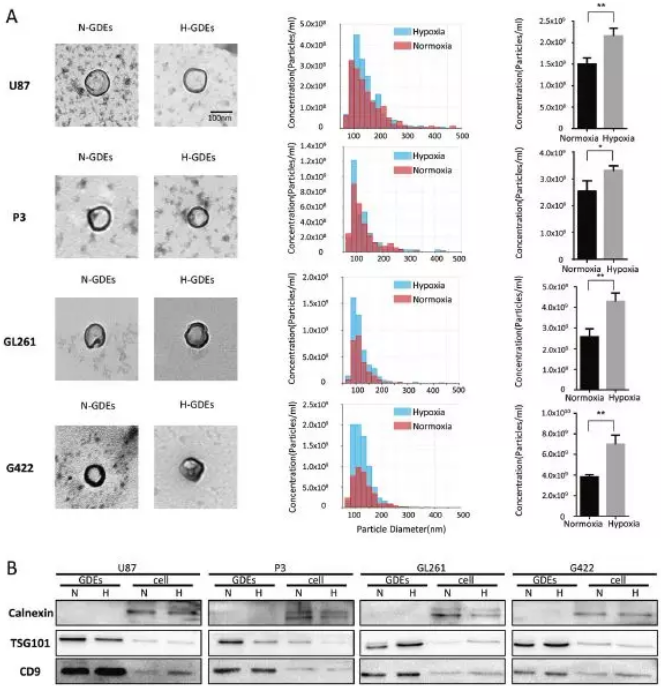
首先鉴定胶质母细胞瘤是否产生并分泌外泌体:通过密度梯度离心分离上述4种胶质瘤细胞系(U87、P3、GL261和G422)的细胞上清液外泌体,电镜(TEM)以及qNano粒径和浓度检测发现缺氧未影响外泌体形态和直径分布(50-150 nm),但增加了人和小鼠神经胶质瘤细胞的外泌体分泌;western blot鉴定了外泌体标志蛋白TSG101和CD9表达以及阴性标志蛋白内质网分子伴侣Calnexin的表达缺失。
2、MDSC吸收GDEs
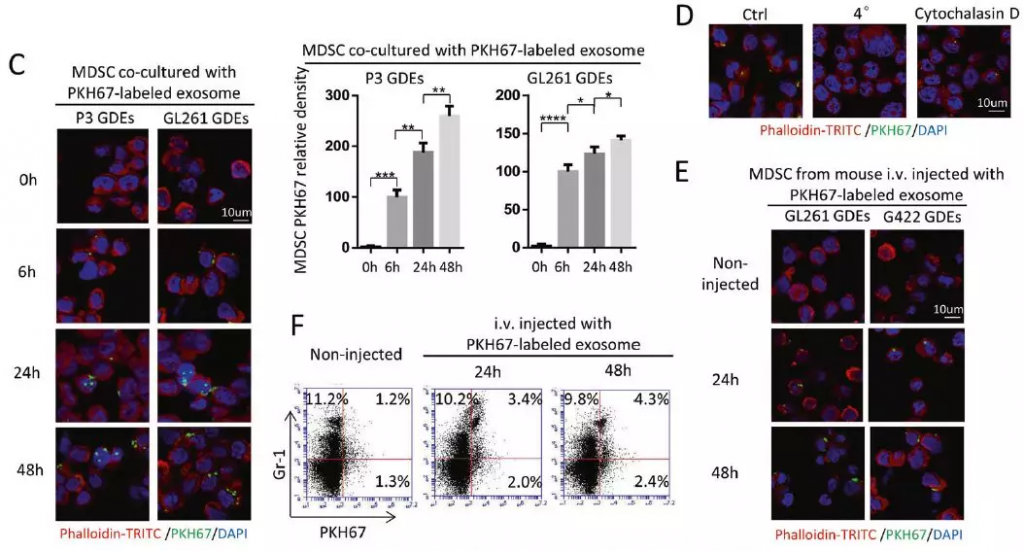
共聚焦显微镜测量MDSC内PKH67荧光标记GDEs的含量变化,结果表明随时间推移MDSC对GDEs的吸收增加。将MDSC与标记的GDE在4℃孵育6小时或与细胞松弛素D(肌动蛋白聚合抑制剂)在37℃孵育6小时,在2种条件下外泌体摄取都减少,这表明GDEs的摄取是温度依赖性和肌动蛋白依赖性的。体内实验:将PKH67标记的GDEs静脉注射(i.v.)入C57BL / 6小鼠,流式细胞术分析显示,静脉注射(i.v.)后24和48小时,脾脏组织中分别有25.0%和30.4% Gr-1+细胞检测到PKH67荧光信号。
3、H-GDEs诱导MDSC能力更强
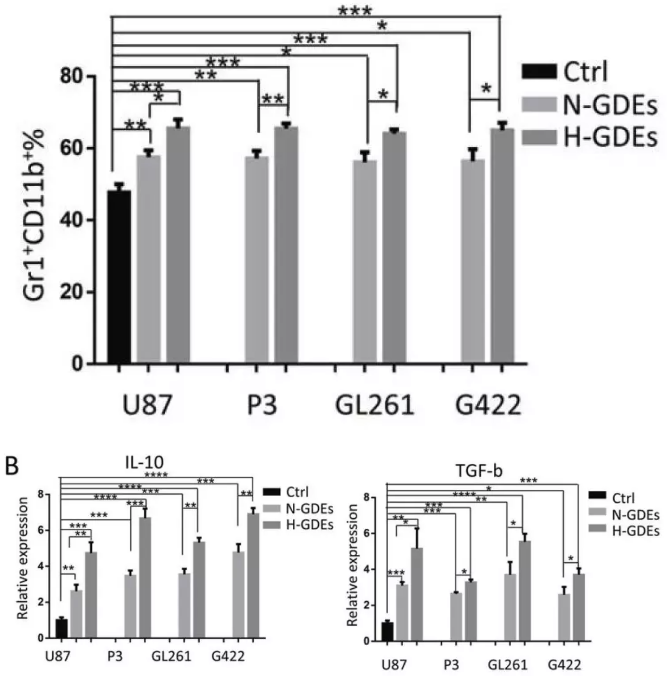
为了验证GDEs是否促进MDSCs分化以及H-GDEs是否具有更强的MDSCs诱导能力,作者用从U87、P3、GL261和G422神经胶质瘤细胞上清分离的PBS、N-GDEs或H-GDEs刺激小鼠BM(Bone marrow,骨髓)细胞。无GDEs时,大多数骨髓细胞分化成具有GM-CSF和IL-6的骨髓树突状细胞;相比之下,与用PBS处理的对照组细胞相比,用从4种神经胶质瘤细胞系收集的GDE处理的骨髓细胞衍生的细胞培养7天,增加了Gr-1+CD11b+MDSC的分化,H-GDEs表现出比N-GDEs更强的Gr-1+CD11b+细胞诱导能力。通过qRT-PCR验证H-GDEs诱导与免疫抑制功能相关基因的潜在影响,结果表明H-GDEs诱导组TGF-β和IL-10的表达上调更明显。
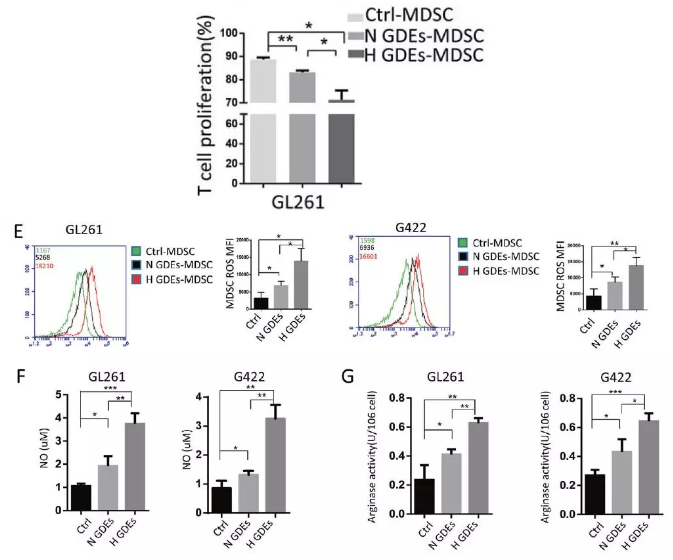
接下来进行一步确定H-GDEs诱导的小鼠脾脏的MDSCs是否比N-GDEs和PBS诱导的功能更强效。首先磁珠分选不同组的小鼠脾脏MDSCs,MDSCs与正常小鼠脾细胞共培养,测定CD8+淋巴细胞的增殖。结果表明不同处理组MDSCs对CD8+淋巴细胞的增殖抑制能力:H-GDEs > N-GDEs >PBS。已有研究表明MDSC通过产生NO和ROS(活性氧)来抑制抗肿瘤免疫,小鼠分别静脉注射PBS、N-GDEs或H-GDEs,检测NO和ROS含量以及精氨酸酶水平:H-GDEs > N-GDEs >PBS。免疫抑制性细胞因子IL-10和TGF-β分泌水平比较:而H-GDEs > N-GDEs >PBS。
综上,GDE具有诱导MDSC扩增并增强其免疫抑制功能的潜力,H-GDE具有更强的MDSC诱导效应。
4、H-GDEs和N-GDEs特定的miRNA表达谱
最近研究表明,外泌体主要通过其功能性RNA成分在细胞通讯中发挥重要作用,其中miRNA含量最丰富(占总外泌体RNA的76.2%)。对从正常刺激和缺氧刺激的人成胶质母细胞瘤U87细胞的条件培养基中分离GDE进行miRNA测序:分别有216种和94种小RNA只在H-GDEs或N-GDEs中特异表达,共计114和191个小RNA分别在N-GDEs和H-GDEs中富集。20种最高表达(Top 20)的miRNA分别占N-GDEs和HGDEs中全部miRNA含量的85.3%和82.9%,H-GDEs中所有20种最高表达的miRNA表达水平都高于N-GDEs中其表达水平。表明20个表达最高的低氧诱导miRNA是在GDE诱导的MDSC扩增和活化中起关键作用的潜在生物因子。接下来,选取其中的6个miRNA(miR-100-5p、miR-92a-3p、miR-21-5p、miR-10a-5p、miR-29a-3p和miR-30d- 5p)进行验证,6种miRNA在缺氧刺激的U87细胞上清中分离的GDE(H-GDEs)中均表达上调,除miR-30d和miR-100-5p外,其他4种miRNA在3种胶质瘤细胞系分泌的H-GDEs中表达量增加,这与NGS结果相符。
MDSC对于肿瘤生长具有重要作用,作者假设胶质母细胞瘤细胞到MDSC的细胞间miRNA转移(细胞间通讯)可能有助于它们的增殖。
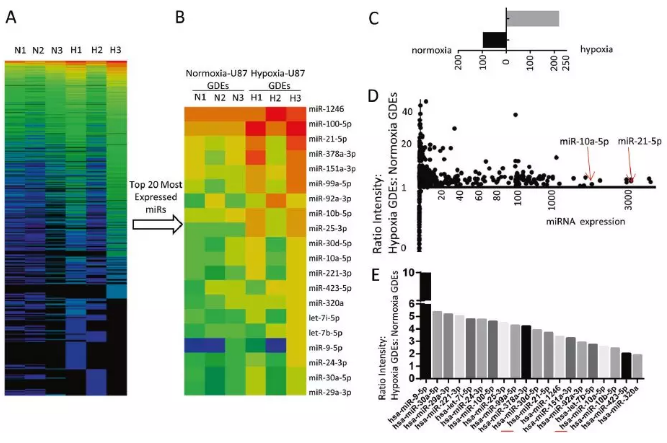
5、缺氧诱导的GDE miR-10a和miR-21促进MDSC的扩增和功能
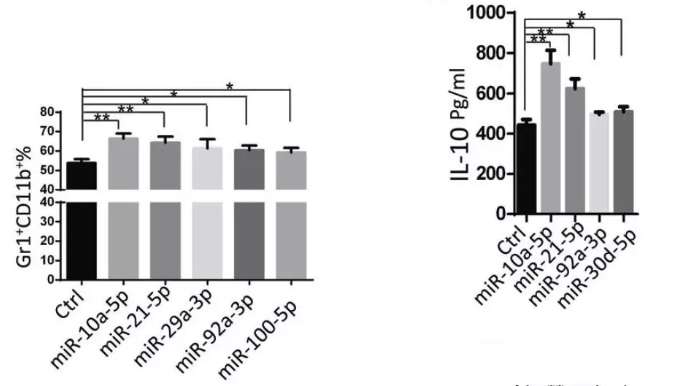
在小鼠骨髓细胞中过表达上述H-GDEs中表达量最高并在小鼠中表达的17种miRNA,评估MDSC的扩增效果。miR-10a和miR-21过表达组相比对照组和其他15个miRNA具有更高比例的Gr-1+CD11b+MDSC,且miR-10a转染的MDSC产生ROS最多,miR-10a和miR-21上调MDSC中免疫抑制细胞因子TGF-β和IL-10的表达,但IL-12表达没有显著改变。结果表明,miR-10a和miR-21在17种最高表达的H-GDEs miRNA中具有最强的促进MDSC扩增效应,并显著增强了MDSC的免疫抑制功能。随后的研究集中在验证缺氧诱导的GDE miRNAs miR-10a和miR-21是否是调节MDSCs扩增和功能的潜在分子。
作者建立了miR-10a和miR-21稳定过表达/敲减的GL261和G422细胞系,常氧条件下培养过表达miR-10a或miR-21或二者均表达的胶质瘤细胞系,或缺氧培养miR-10a或miR-21敲减的胶质瘤细胞系,分离培养基中外泌体,鉴定外泌体中2种miRNA表达量,结果表明过表达细胞系来源的外泌体中miR-10a和miR-21上调约20倍,缺氧诱导的miR-10a和miR-21在miRNA敲除细胞系来源的外泌体中表达减弱。为验证GDE介导miRNA转运,从GL261神经胶质瘤细胞系荷瘤小鼠中分选MDSC分别与以下各GDEs体外共培养:N-GDEs、N + 10GDEs和N + 21GDEs(过表达miR-10a和 miR-21的N-GDEs)、H-GDEs、H-10KO GDEs和H-21KO GDEs(敲减miR-10a和 miR-21表达的H-GDEs)。通过qRT-PCR测量GDE刺激的MDSC中miR-10a和miR-21的表达,结果表明H-GDEs比N-GDEs刺激的MDSC具有更高的miR-10a / miR-21表达水平,N + 10GDEs和N + 21GDEs组MDSC中相应miRNA表达量升高,H-10KO GDEs和H-21KO GDEs组相应miRNA表达量未升高。体内实验:尾静脉注射PBS和以上各GDEs,也表明GDEs注射促进MDSC miR-10a和miR-21表达。
正常小鼠分离骨髓细胞与GDEs共培养,鉴定各GDEs的MDSC诱导能力:N + 10GDEs和N + 21GDEs诱导MDSC能力强于N-GDEs,N + 10+21 GDEs(同时过表达2种miRNA)具有最强的MDSC诱导能力,表明二者间具有协同作用,敲减组H-GDEs则MDSC扩增减弱。表明H-GDEs通过增加miR-10a和miR-21的表达来体外诱导MDSC的增殖。
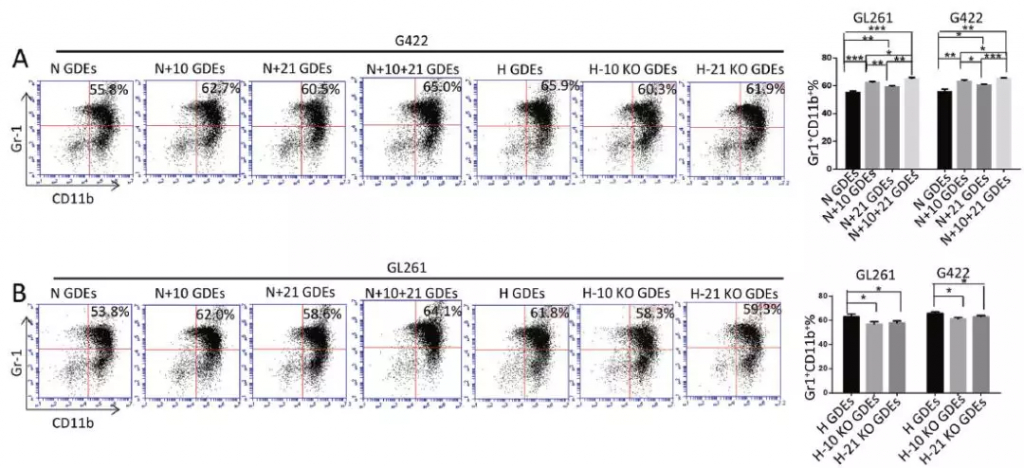
小鼠静脉注射体内实验结果与体外共培养结果一致,缺氧刺激的miR-10a / miR-21敲除神经胶质瘤细胞不能产生介导MDSC扩增的外泌体,但正常的H-GDE可介导MDSC扩增。进一步分离上述小鼠的MDSC,评估其对CD8+淋巴细胞增殖抑制作用,N + 10GDEs和N + 21GDEs组抑制能力更强,而敲减2种miRNA的H-GDEs诱导的MDSC的免疫抑制作用减弱。
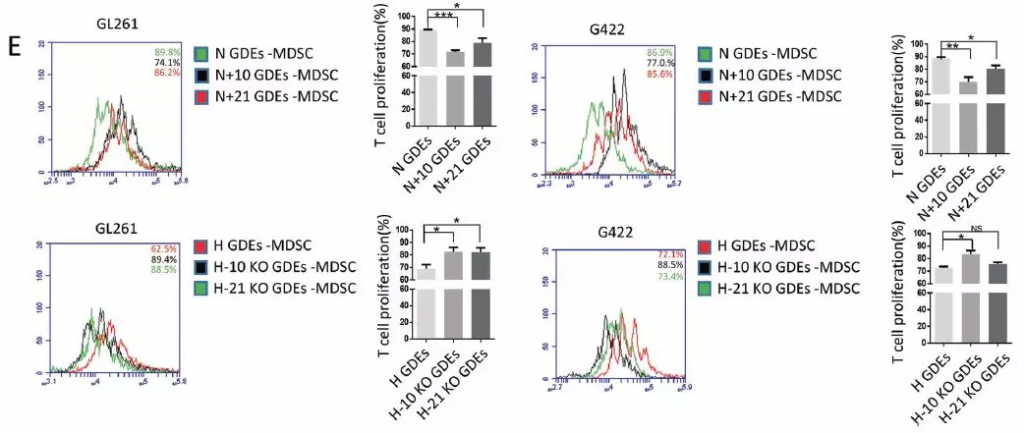
对上述GDE注射的小鼠分离的MDSC产生的免疫抑制因子(包括ROS、精氨酸酶活性、NO、IL-10和TGF-β)进行检测,N + 10GDEs组相比于N-GDEs产生更多的ROS、精氨酸酶活性、NO、IL-10和TGF-β,而敲减组H-10KO GDEs则产生更少的免疫抑制因子。miR-21过表达或敲减仅对MDSC产生的部分免疫抑制因子有影响,比如IL-10。
综上,GL261和G422来源的H-GDEs诱导的MDSC扩增受到GDEs中miR-10a和miR-21的缺氧诱导表达调控。MDSC免疫抑制功能被GDEs中缺氧诱导的miR-10a表达增强,转运到MDSC的HGDE miR-21仅部分促成了MDSC的抑制功能。
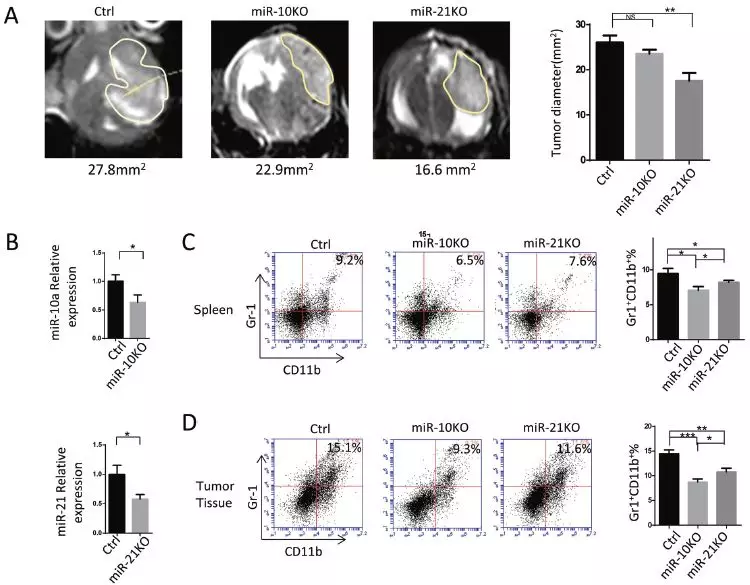
6、miR-10a和miR-21敲减胶质瘤细胞在体内诱导较少量的功能性MDSC
原位胶质瘤小鼠模型研究GDE-MDSC诱导效应:将miR-10a敲除、miR-21敲除或对照小鼠神经胶质瘤GL261细胞颅内注射入小鼠,T2WI-MRI评估植入后4周的肿瘤体积,结果:miR-21敲除组的肿瘤体积小于对照组。MRI扫描后1天处死小鼠,分离脾脏MDSC验证miR-10a和miR-21表达水平,并对三组小鼠脾脏和肿瘤中MDSC比例进行检测,miR-10KO和miR-21KO组,miR-10a和miR-21敲减均减少脾和肿瘤组织中MDSC的积累,miR-10a尤甚,miR-10a敲减GL261小鼠的MDSC比对照组具有更低水平的CD8+淋巴细胞抑制效应及产生更少的免疫抑制因子(ROS、精氨酸酶活性、NO和IL-10)。
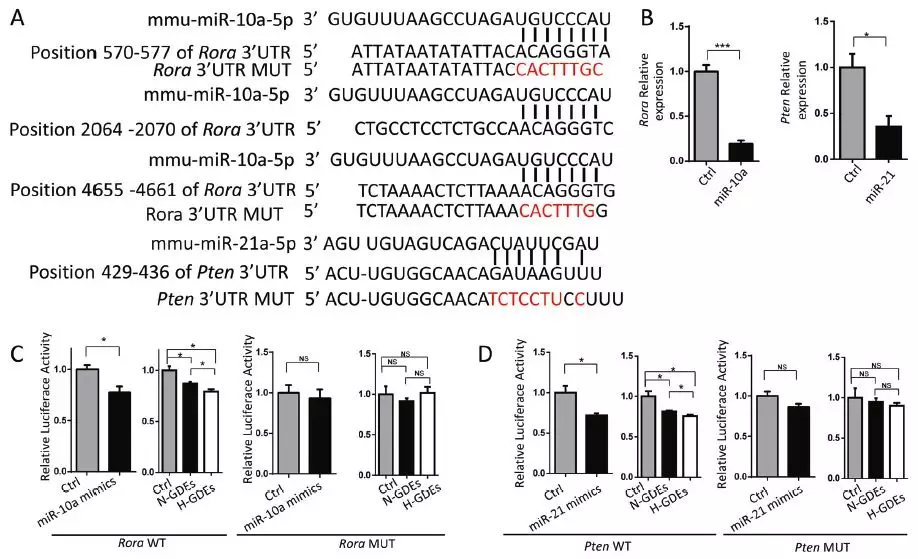
7、GDEs miR-10a和miR-21通过靶向RORA和PTEN增强MDSC扩增
前人研究了经典的MDSC激活途径,包括AKT-PI3K、NF-κB、STAT1、STAT3、STAT5和STAT6,作者假设miR-10a和miR-21直接靶向参与增强MDSC扩增的负调控基因。首先,通过TargetScan和miRDB预测其靶基因,并分析miRNA靶基因与MDSC激活途径之间的相互作用,得到miR-10a靶基因Rora和Tak1以及miR-21靶基因Pten。作者进一步分析了miRNA抑制靶基因表达,结果表明miR-10a和miR-21分别抑制Rora和Pten基因表达。构建3’UTR种子序列突变体和野生型3’UTR进行双荧光素酶报告基因试验,表明miR-10a直接结合Rora基因3’UTR从而抑制其表达。常氧刺激和缺氧刺激的GL261 GDEs也降低了用Rora和Pten萤光素酶报告基因转染的MDSC中的荧光,H-GDEs组的MDSC中荧光值更低,突变miRNA结合元件则消除荧光减弱作用。
进一步从胶质瘤荷瘤小鼠中分离MDSC,用PBS、N-GDEs或H-GDEs体外刺激MDSC,qRT-PCR检测GDEs对MDSCs中Rora和Pten的基因表达抑制作用,H-GDEs对Rora和Pten表达的抑制作用比N-GDEs强。静脉注射N-GDEs或H-GDEs也下调脾脏中MDSC的Rora和Pten表达。
为了验证RORA和PTEN对MDSCs扩增和免疫抑制功能的抑制作用,作者沉默了骨髓细胞中的PTEN和RORA表达,并检测了分化的MDSC的增殖和功能。RORA和PTEN敲低均促进骨髓细胞分化为MDSCs,也增强了MDSCs中的ROS产生和IL-10表达。这表明,GDE miR-10a和miR-21分别抑制RORA和PTEN的表达,并随后促进MDSC的扩增(分化)和免疫抑制功能。
8、H-GDEs诱导的MDSC激活由miR-10a/Rora/IκBα/NF-κB和miR-21/Pten/PI3K/AKT途径介导
为了确定miR-10a与Rora UTR的结合是否可以调节RORA表达,并随后影响IκBα和NF-κB的表达,用miR-10a和RORA siRNA转染从小鼠骨髓细胞诱导的MDSC以及神经胶质瘤荷瘤小鼠的脾脏分离的MDSC。miR-10a和RORA siRNA转染均下调细胞质中的RORA和IκBα表达,细胞质中NF-κB(p65)的产生不受影响,但其在细胞核中的表达水平显著增加。N-GDEs和H-GDEs处理组通过RORA /IκBα途径,也促进了MDSCs中NF-κB的核易位和转录活性,尤其是H-GDEs处理组。在H-GDEs中沉默miR-10a表达减弱了它们对MDSCs中NF-κB核内易位和转录活性的促进作用,并且N-GDEs中过表达miR-10a增强了这种促进作用。
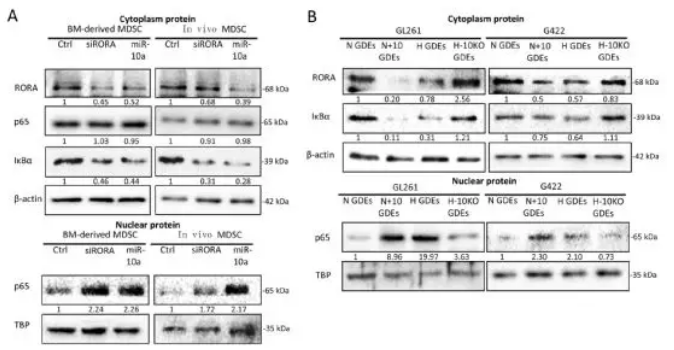
接下来,作者评估了miR-21介导的MDSC激活途径。在骨髓细胞分化的MDSC和胶质瘤荷瘤小鼠中分离的MDSC中转染miR-21和PTEN siRNA,下调PTEN的表达并激活p-AKT的表达。GDEs激活p-AKT表达,而H-GDEs是比N-GDEs更强的PTEN抑制剂和p-AKT激动剂。在N-GDEs中过表达miR-21可激活MDSC PTEN / AKT途径,而在H-GDEs中沉默miR-21可抑制该途径。
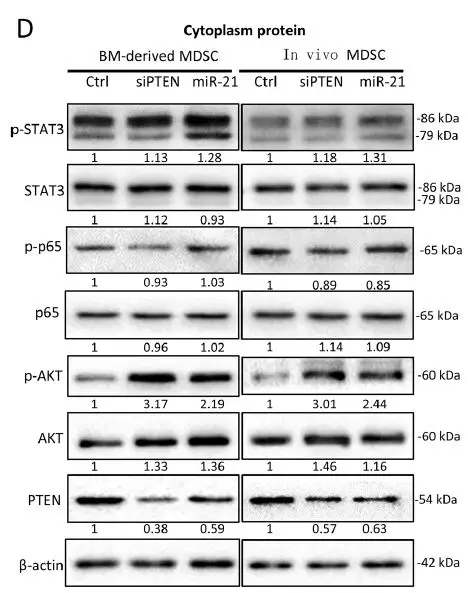
为进一步验证H-GDE miR-10a和miR-21通过NF-κB和AKT / PI3K途径介导MDSCs的扩增和活化,作者评估了NF-κB抑制剂PDTC和PI3K抑制剂LY294002对GDE诱导MDSC激活的作用。NF-κB抑制剂PDTC可消除由miR-10a和H-GDEs诱导的NF-κB核易位和转录活性。PI3K抑制剂LY294002不影响miR-21抑制PTEN,但抑制AKT活化,PDTC和LY294002减弱了HGDEs体外诱导的MDSC扩增, PDTC也下调H-GDE MDSC中的ROS产生。
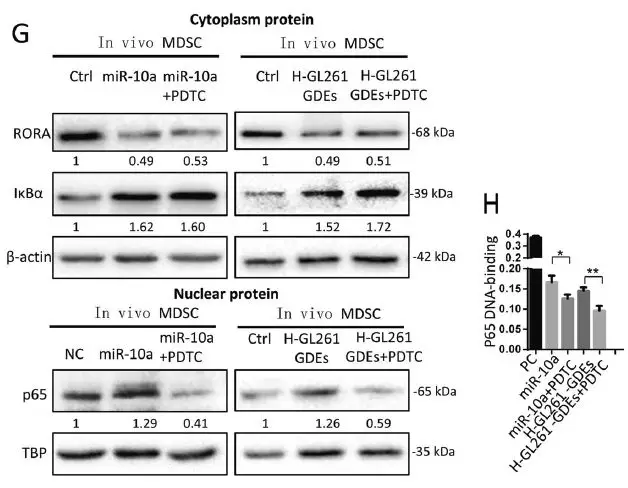
这些结果表明由H-GDEs诱导的MDSC活化由miR-10a / Rora /IκBα/ NF-κB和miR-21 / Pten / PI3K / AKT途径介导。
小结、:本研究首次报道miR-10a靶向Rora基因,并通过激活NF-κB通路进一步增强MDSC活性。讲述了涉及小鼠和人类的胶质瘤诱导的耐受性免疫抑制途径:阐明了胶质瘤细胞通过外泌体影响MDSCs的分化和活化的机制,并且证明局部胶质瘤缺氧如何影响整个肿瘤免疫环境。这支持外泌体RNA转移作为细胞间通讯的手段,从而使得肿瘤细胞影响免疫细胞的转录组,并且提供了用于研究缺氧和肿瘤免疫微环境之间关系的新方法。
参考文献:Guo X, Qiu W, Liu Q, et al. Immunosuppressive effects of hypoxia-induced glioma exosomes through myeloid-derived suppressor cells via the miR-10a/Rora and miR-21/Pten Pathways[J]. Oncogene, 2018.





来第一个抢占沙发评论吧!