作者:bioWorld
环状RNA(circRNA)大部分是由蛋白质编码基因产生,并大多积累在细胞质中,但是如何控制circRNA定位或核输出仍不清楚。
5月17日,美国宾夕法尼亚大学的研究人员在Genes & Development杂志(IF=9.413)发表题为:A length-dependent evolutionarily conserved pathway controls nuclear export of circular RNAs 的研究论文。该研究使用RNAi筛选,发现了果蝇和人类的circRNA定位关键调节因子,确定了circRNA定位以及核输出机制,证实成熟circRNA的长度决定了其核输出模式。

由于circRNA对核酸外切酶的降解具有天然的抵抗力,因此其在一些细胞的累积水平比相关线性mRNA高得多。大多数circRNA功能依然未知,但有些已被证实是作为miRNA的海绵。
尽管已经报道了一些circRNA在细胞核中积累,但大多数被有效输送到细胞质中。由于许多circRNA在包括神经元在内的非分裂细胞中表达,所以circRNA输出细胞核的方式肯定不仅仅依赖于有丝分裂期间的核膜破裂。然而目前尚未发现circRNA主动转运出细胞核的机制。
RNA通常与能够通过核孔复合物的输出受体结合,从而到达细胞质。该研究中,作者使用RNAi筛选来确定调控circRNA定位和核输出的因子。
DexH/D-box解螺旋酶决定circRNA在细胞核的积累
在果蝇DL1细胞中circRNA的定位,来源于laccase2和dati基因的circRNA都主要定位于细胞质中,而不管它们是从其内源基因座还是表达质粒产生的。
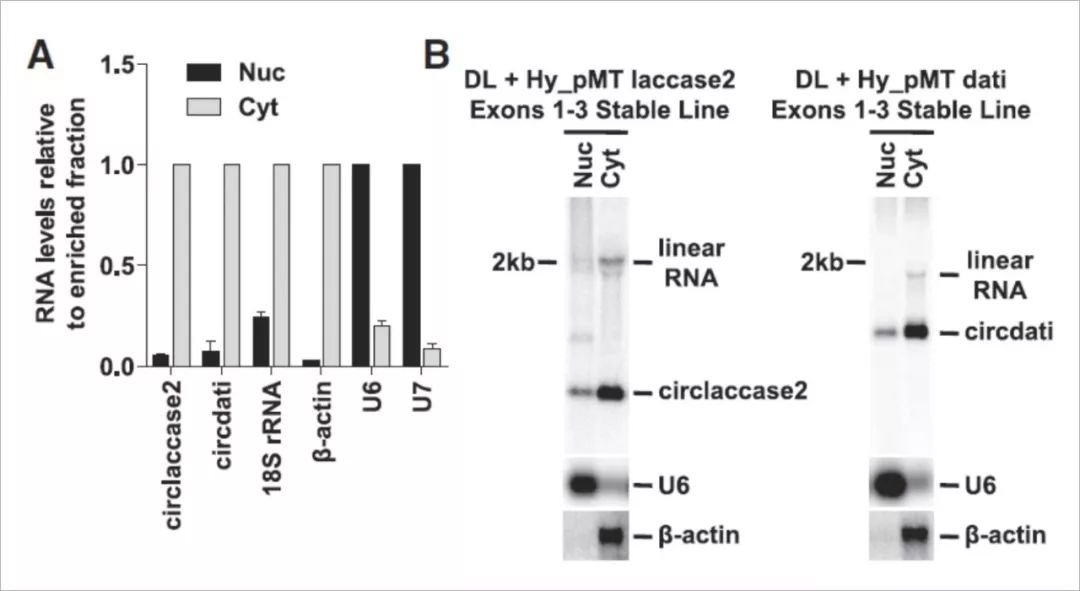
我们推断RNAi筛选可用于揭示控制circRNA定位的因子,并且因此使用siRNA将26种在各种类型的RNA的核输出中已知作用的蛋白分别在DL1细胞中敲低3天。
发现DExH/D-box解旋酶Hel25E的消耗导致长度为1120nt的circdati转录物的核积累。该表型不是由于总circdati表达的总体变化造成的,由于Hel25E是包括热休克因子mRNA在内的许多果蝇mRNA的核输出所必需的,因此得出结论:circdati的有效核输出需要线性mRNA输出所需的一部分因子。
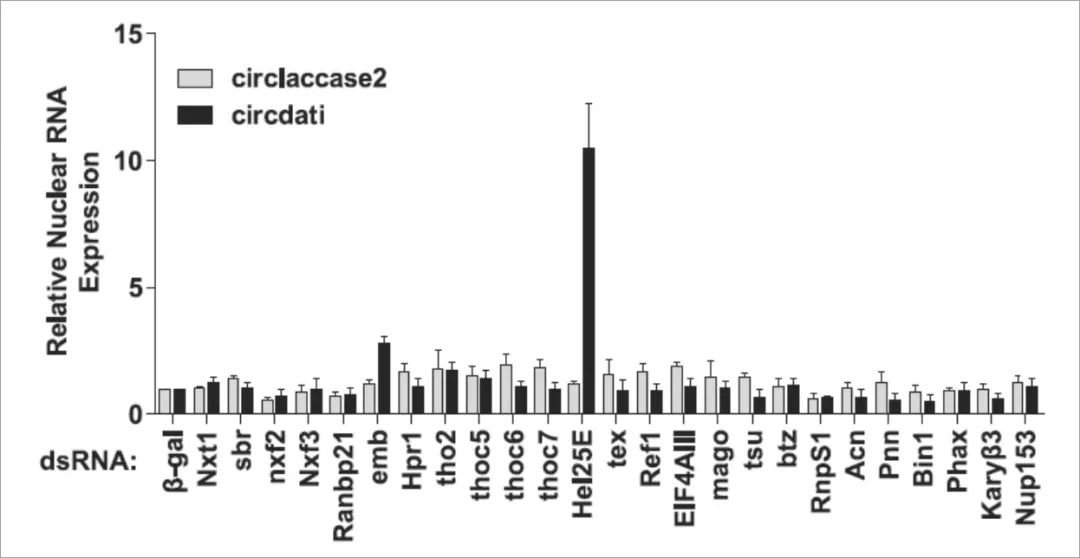
果蝇只有长circRNA(> 800 nt)需要Hel25E进行核输出
实验发现,当Hel25E被耗尽时,这个长度为490nt的circlaccase2并不会在细胞核中累积,接下来作者检查了另外12种具有不同长度和外显子数的circRNA的定位。成熟circRNA核中积聚与外显子数目之间没有相关性。 相反,核内累积的所有circRNA长度> 811nt,而所有Hel25E非依赖性转录物<702nt。 这表明成熟circRNA的长度可能决定了核输出机制,Hel25E有效输出> 800nt的circRNA。
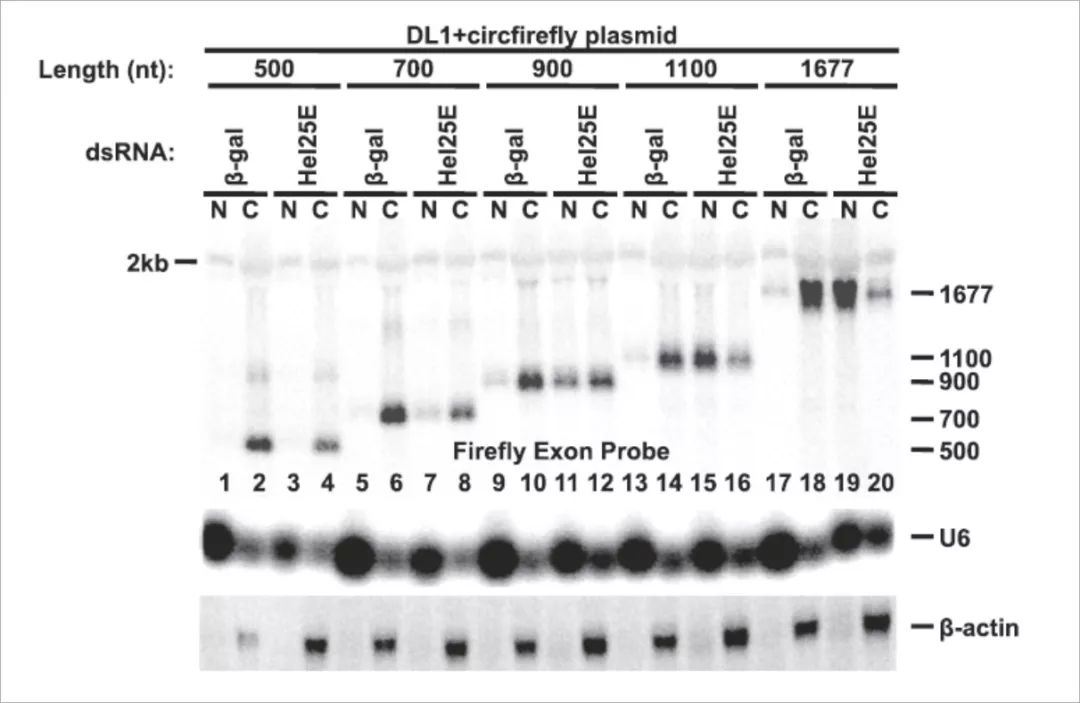
为了直接测试该长度依赖性输出模型,我们产生表达质粒,其产生来自萤火虫萤光素酶基因的不同长度(500,700,900,1100和1677nt)的成熟circRNA。随着circfirefly外显子长度逐渐增加,当Hel25E被耗尽时,越来越多的转录物在核内累积。
这些实验数据表明:随着转录本长度的增加,果蝇circRNAs的核输出越来越依赖于Hel25E。需要注意的是,当Hel25E被敲低后,circRNA并没有完全保留在细胞核,所以可能存在独立于Hel25E的circRNA核输出模式。
BioWorld注:此处结论并不严谨,文中使用siRNA并不能完全敲除UAP56和URH49,因此不能说明circRNA未完全保留在细胞核是因为有其他输出模式。感兴趣的读者可以用Cas9敲除验证一下。
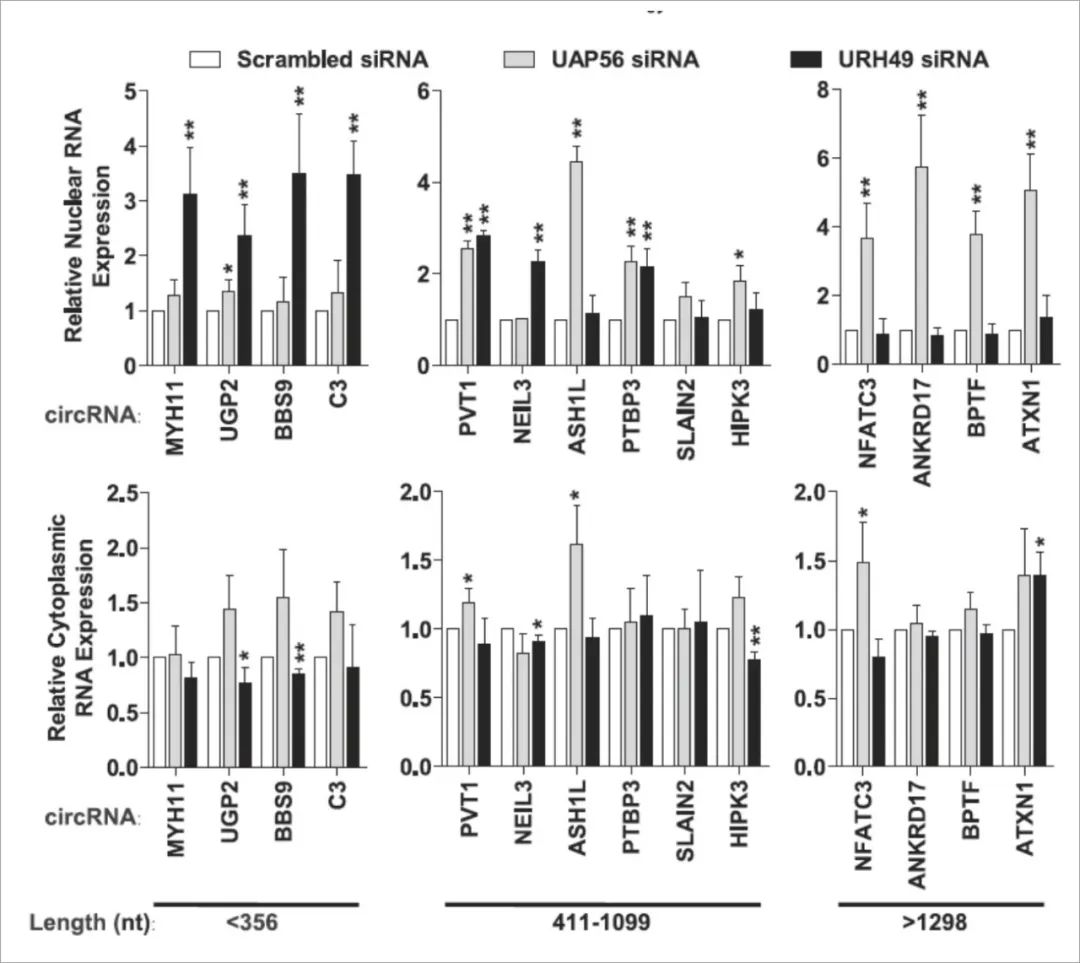
果蝇Hel25E的同系物:UAP56和URH49,控制人类circRNA的定位
内源性人类circRNA也主要定位于细胞质,人类有UAP56(DDX39B)和URH49(DDX39A)这两个Hel25E的两个同系物,它们是否同样影响了circRNA定位模式呢?
此前UAP56和URH49已被证实涉及许多人类mRNA的核输出。使用qRT-PCR来检测14种不同长度和外显子的内源人类circRNA的定位。
URH49敲低时,长度<356nt的circRNA累积在细胞核中,但其定位明显不受UAP56消耗的影响。
UAP56敲低时,长度>1298nt的circRNA累积在细胞核中,但其定位明显不受UAP49消耗的影响。
对于长度在411到1099nt之间的circRNAs,调控似乎更复杂,可能是因为RNA二级结构影响了成熟circRNA的整体紧凑性。
总之,URH49和UAP56分别调节短(<400nt)和长(> 1200nt)circRNA的定位。
Hel25E同系物中四个氨基酸的变化控制了它们的circRNA长度偏好
为了确定Hel25E的关键调节基序,使用siRNA在DL1细胞中敲低内源性Hel25E,并通过从质粒表达突变型Hel25E的rescue实验来挽救circRNA核定位表型。
在表达具有大大降低的ATP结合亲和力(K91N)或解旋酶活性(D193E)的Hel25E突变体的细胞中,所检测的五种长circRNA中的四种有效地输出至细胞质。这表明Hel25E的酶功能对于长circRNA输出而言在很大程度上是不必要的。
接下来推论,控制circRNA长度偏好的氨基酸应该在Hel25E和UAP56(其作用于长circRNAs)之间保守,但在URH49(其作用于短circRNAs)中不保守。我们确定了一个位于底物结合域和解旋酶域之间的4-氨基酸基序,它们符合以下特征:Hel25E / UAP56中存在K-K / S-L-N基序,而URH49中存在R-S-F-S基序。
为了测试这四种氨基酸是否确实影响circRNA长度偏好,我们用Hel25E/UAP56基序产生表达具有URH49基序和突变型URH49蛋白的突变型Hel25E/UAP56蛋白的质粒。从DL1细胞中去除内源Hel25E,然后转染质粒rescue。
与预期一致,野生型Hel25E或UAP56显著挽救了多个长circRNA,的核积累,但野生型URH49没有。突变URH49以使其含有Hel25E/UAP56基序足以使其挽救长circRNA核输出缺陷。同样,突变Hel25E或UAP56,使它们含有URH49基序,导致其不再挽救长circRNA的核积累。
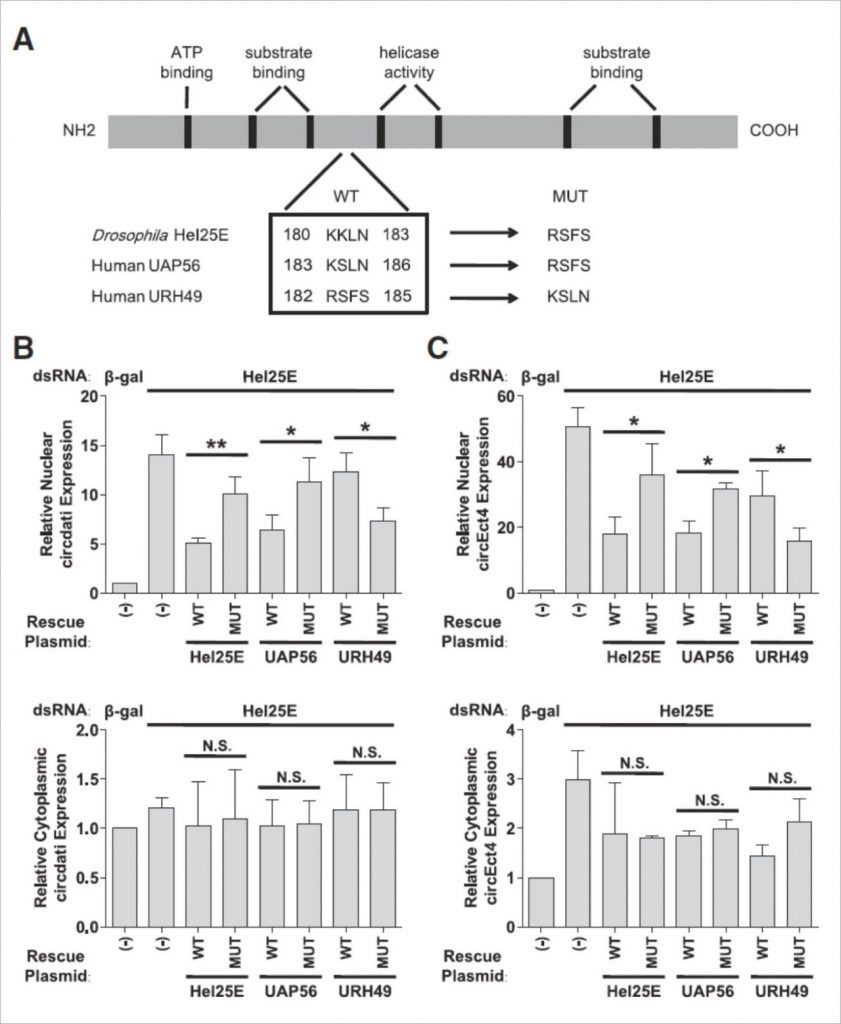
这些数据清楚地表明,不同的4-氨基酸基序对于决定Hel25E同系物的circRNA长度偏好是必需和足够的。
总的来说,尽管circRNA具有不同的长度、序列和结构,但这项研究证明这些转录物通过进化保守因子衡量成熟circRNA的长度来进入特定的核输出途径。




来第一个抢占沙发评论吧!