肿瘤中miRNA整体表达量的显著下调与肿瘤发生发展密切相关,但miRNA下调的分子机制尚不明确。由转运蛋白XPO5负责的前体miRNA(pre-miRNA)核质转运是miRNA生物合成的重要步骤。
2016年,四川大学生物治疗国家重点实验室彭勇教授课题组与美国科学院院士Carlo M. Croce教授课题组在 Cancer Cell 上共同发表题为ERK activation globally downregulates miRNAs through phosphorylating exportin-5 的文章,阐明了癌基因ERK介导的miRNA生物合成的转录后调控新机制(肿瘤细胞中miRNA表达量为何整体降低?Cancer Cell告诉你答案)。
在上述文章中,研究人员首次发现肝癌中转运蛋白XPO5被激酶ERK磷酸化后,无法有效转运pre-miRNA,从而引起成熟miRNA表达降低,促进肝癌发展。而且,肝脏中最重要的抑癌miRNA miR-122的下调可导致Septin-9表达上调,促进微管解聚,使肝癌细胞对紫杉醇产生耐药。该研究不仅从蛋白翻译后水平的新角度阐明了miRNA生物合成的分子机制,还在非编码RNA层面解析了癌基因ERK促进肿瘤发生发展的新途径【1】。
近日,彭勇教授以独立通讯作者的身份在 Cell Death & Differentiation 和 Hepatology 分别刊登了题为Pin1 impairs microRNA biogenesis by mediating conformation change of XPO5 in hepatocellular carcinoma 和Targeting Pin1 by inhibitor API-1 regulates microRNA biogenesis and suppresses hepatocellular carcinoma development的两篇研究文章,深入解析了脯氨酰异构酶Pin1在miRNA生物合成的关键作用,并提出了靶向Pin1的肝癌治疗新策略。


在 Cell Death & Differentiation 上的最新研究发现,磷酸化的XPO5蛋白被脯氨酰顺反异构酶Pin1的WW结构域识别,其pSer-Pro基序在Pin1蛋白PPIase结构域的催化下发生顺反异构,导致XPO5构象改变,不能结合pre-miRNA,抑制了pre-miRNA核质转运,从而下调成熟miRNA的表达(图1)。更重要的是,肝癌细胞中Pin1的敲低能恢复XPO5对pre-miRNA的核质转运,在体内及体外水平上显著抑制肝癌生长。该发现不仅从更深层次解析了肝癌中miRNA表达下调的原因,而且系统阐释了ERK-Pin1-XPO5协同调控前体miRNA核质穿梭这一重要科学问题,为Pin1作为肝癌治疗新靶点提供了实验证据和理论支持【2】。
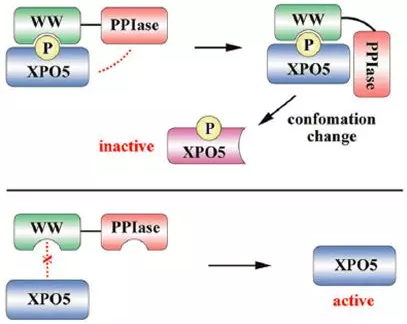
图1
由于肝癌是全球发病率最高的恶性肿瘤之一,尤其针对我国,肝癌防治形势严峻,每年有大约47万新增肝癌病例,占全球发病人数的55%,然而有效的肝癌治疗手段仍然非常缺乏。彭勇课题组在Hepatology发表的最新成果,首次阐述了基于miRNA表达调控的肝癌靶向治疗新策略。
前述研究工作已表明,Pin1是潜在的肝癌治疗新靶点,研究者通过计算机辅助药物设计,发现了特异性的Pin1抑制剂API-1。研究证明,API-1特异性地结合至Pin1蛋白的PPIase结构域并有效抑制Pin1催化活性,恢复XPO5对pre-miRNA的转运功能,上调miRNA表达(图2)。重要的是,API-1具有很好的靶标特异性,体内及体外水平的实验均证实API-1对Pin1高表达/XPO5高磷酸化水平的肝癌细胞尤为敏感,为肝癌精准治疗提供了新方案,具有良好的临床应用潜力【3】。
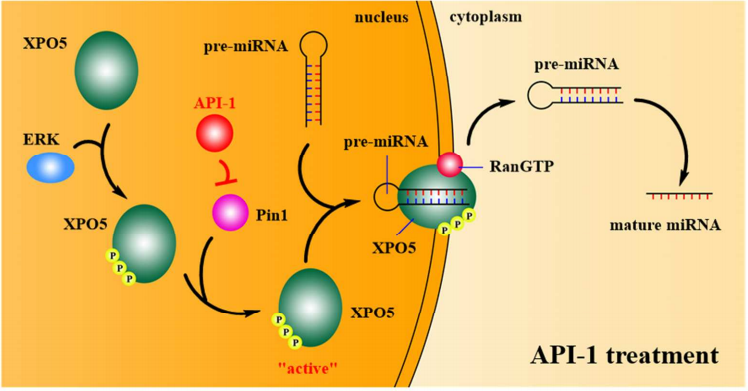
图2
总的来说,彭勇课题组在围绕“miRNA转录后调控”这一核心问题,开展了系统的研究工作:深入解析了肿瘤中miRNA转录后调控的新机制,而且紧密结合基础研究与临床转化,发现了可用于肝癌治疗的候选药物,为肝癌靶向治疗提供新的思路。
此外,值得一提的是彭勇课题组日前还在Cell Research杂志上发表了题为“Circular RNA F-circEA produced from EML4-ALK fusion gene as a novel liquid biopsy biomarker for non-small cell lung cancer”的研究论文,鉴定出非小细胞肺癌EML4-ALK融合基因产生的环状RNA——F-circEA。证明了F-circEA能促进细胞迁移和侵袭。更重要的是,几乎所有EML4-ALK阳性的肺癌患者的血浆中都能特异性检出F-circEA,而未携带该融合基因的患者的血浆中未见F-circEA存在。这意味着血浆检出F-circEA的肺癌患者一定携带EML4-ALK融合基因,可通过ALK靶向药物克唑替尼(Crizotinib)进行临床治疗。因此,该研究不仅揭示了融合基因促进肿瘤进展的新机制,而且证明了血浆F-circEA可用于诊断融合基因和指导临床用药,为推动肺癌精准医疗提供理论依据。

参考文献
1. Sun HL, Cui R, Zhou J, Teng KY, Hsiao YH, Nakanishi K, Fassan M, Luo Z, Shi G, Tili E, Kutay H, Lovat F, Vicentini C, Huang HL, Wang SW, Kim T, Zanesi N, Jeon YJ, Lee TJ, Guh JH, Hung MC, Ghoshal K, Teng CM, Peng Y, Croce CM. ERK activation globally downregulates miRNAs through phosphorylating exportin-5. Cancer Cell 2016, 30(5): 723-736.
2. Li J, Pu W, Sun HL, Zhou JK, Fan X, Zheng Y, He J, Liu X, Xia Z, Liu L, Wei YQ, Peng Y. Pin1 impairs microRNA biogenesis by mediating conformation change of XPO5 in hepatocellular carcinoma. Cell Death Differ. 2018, doi: 10.1038/s41418-018-0065-z.
3. Pu W, Li J, Zheng Y, Shen X, Fan X, Zhou JK, He J, Deng Y, Liu X, Wang C, Yang S, Chen Q, Liu L, Zhang G, Wei YQ, Peng Y. Targeting Pin1 by inhibitor API-1 regulates microRNA biogenesis and suppresses hepatocellular carcinoma development. Hepatology 2018, doi: 10.1002/hep.29819.
作者简介:
彭勇,教授,博士生导师,四川省千人计划获得者,四川省学术与技术带头人。已在Molecular Cell、PNAS、JBC等期刊发表40余篇论文。自2014年全职回国组建研究团队,围绕肿瘤非编码RNA开展了系统深入的工作。以通讯作者(含共同通讯作者)在Cancer Cell、Cell Research、Hepatology、Cancer Research、Cell Death & Differentiation、Cancer Letters等期刊发表科研论文。担任Molecular Cancer副主编,Cancer Letters和Molecular and Cellular Life Sciences等期刊编委。目前主持国家自然科学基金面上项目两项,主持国家重点研发计划课题一项,子课题一项。
以上内容出自:BioArt/ID:fullbellies





来第一个抢占沙发评论吧!