近日,北京大学生物动态光学成像中心的黄岩谊,汤富酬和北京大学第三附属医院乔杰合作完成了一项重要的circRNA研究成果:在人类着床前胚胎中系统分析不含PolyA的RNA表达情况,其中发现了大量的circRNA。相关工作发表于Genome Biology杂志上(Dang et al., 2016)。

研究背景:
着床前胚胎中基因表达状态是深入理解胚胎发育过程非常重要的研究方向,本文作者基于他们丰富的单细胞测序经验,针对人类着床前胚胎中PolyA— RNA进行单细胞测序分析。
2013年,汤富酬和乔杰以及李瑞强就曾经在Nature Structural & Molecular Biology发表文章利用单细胞测序技术探索了人类着床前胚胎细胞基因表达情况,当时只是利用Oligo d(T)进行反转录和建库,因此在这个文章中讨论的都是PolyA+的RNA表达情况。

PolyA+的RNA研究技术较成熟,但PolyA— RNA相对而言,研究的还不是非常透彻,在细胞中如何表达并发挥功能是个神秘而有趣的问题。circRNA就是最具有代表性的 PolyA— RNA。因此在本文中,作者共分析了七个不同胚胎发育阶段的细胞,包括利用激光显微切割分离内细胞团和滋养外胚层的细胞,利用他们曾设计和报道的SUPeR-seq技术,最终分析鉴定到了10,032个对应于2974个基因外显子区的circRNA。有趣的是这里涉及到的2974个基因有1554个是母系背景的基因,851个是合子表达的基因,有可能这些母系背景的基因早在卵子发育和成熟过程中就已形成。
主要实验流程与技术:
SUPeR-seq技术最早是2015年汤富酬和黄岩谊合作发表于Gonome Biology杂志的文章中首次提出的:

SUPeR-seq技术主要流程是分离单细胞,用带6nt的末端随机序列结构的引物进行第一链的反转录,然后利用ExoSAP-IT试剂盒去掉剩余的引物,在第一链cDNA的末端增加一段Poly A,再进行第二链合成和建库测序。利用本流程,能涵盖所有PolyA+ RNA和PolyA— RNA。
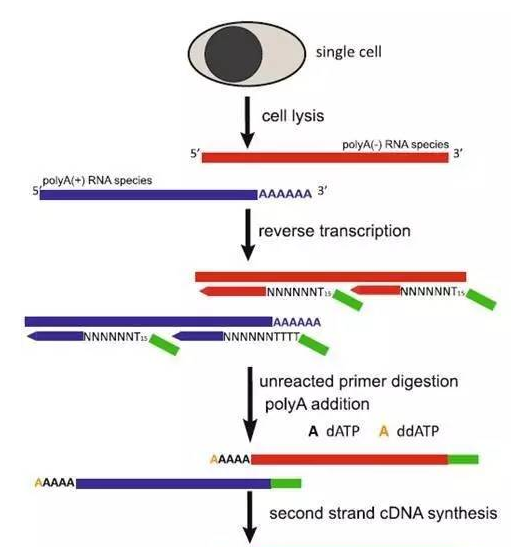
图1 SUPeR-seq流程 (来自(Fan et al., 2015))
胚胎发育相关的circRNA如何鉴定的?
作者利用杨力实验室开发的CIRCexplorer软件分析了测序结果中的circRNA。首先筛选不能完全mapping至hg19的Reads,再鉴定其中同时包含同一基因的两个外显子序列的Reads,且环化位点中间的外显子序列也能找到对应的Reads,每个候选的circRNA环化位点至少能在同一胚胎样本中出现至少两个Reads覆盖的才算有效的circRNA。最后,作者挑选了5个circRNA在人的ES细胞中进行了RNase R消化后QPCR验证。
胚胎发育相关的circRNA有哪些基本特征?
作者鉴定到的circRNA表达特征会随着胚胎发育的进程出现非常大幅度的动态变化过程。平均每个circRNA拷贝数平均为92 copies/胚胎,CSPP1基因对应的circRNA种类最多,高达46种。circRNA形成过程中经常避开第一个和最后一个外显子,在本文中发现的circRNA同样存在这样的特征,在所有10032种circRNA中,10026种是没有第一和最有一个外显子的,而剩下的这6个circRNA中的5个还包含了第一外显子更上游的序列,暗示着可能是进行circRNA注释的过程中带来的非特异性的第一外显子序列。绝大部分circRNA均由多个外显子构成,最多的高达56个外显子。能够形成circRNA的外显子最小长度约200bp。形成circRNA的涵盖区域中内含子的长度要高于对照的内含子长度,其中Alu元件的丰度也明显高于对照的内含子。
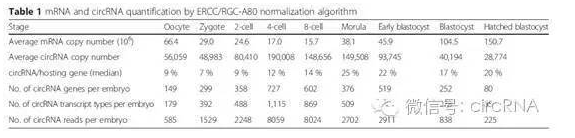
表1 人类胚胎发育过程中mRNA及circRNA表达特征动态变化情况(来自(Dang et al., 2016))
胚胎发育相关的circRNA表达特征如何?
文中也针对发现的circRNA表达状况进行了分析。表达丰度方面,circRNA相对于线性RNA的丰度会随着胚胎发育的进展出现较大的变化,在成熟卵细胞中circRNA的表达量为所对应线性RNA的9%左右,这一比例会一直持续到四细胞期,而到了八细胞期,该比例会迅速升至25%左右。平均而言,circRNA表达丰度约为对应的线性RNA的10%左右,个别的甚至达到或超过线性RNA的丰度。circRNA对应的基因(circRNA hosting gene)表达情况与没有检测到circRNA的其他基因(Other coding gene)的表达状态也有非常奇怪的表现:在八细胞期之前,circRNA hosting gene的表达明显高于Other coding gene,而达到八细胞期后就发生了逆转,Other coding gene的表达量迅速上升,超过circRNA hosting gene的表达。
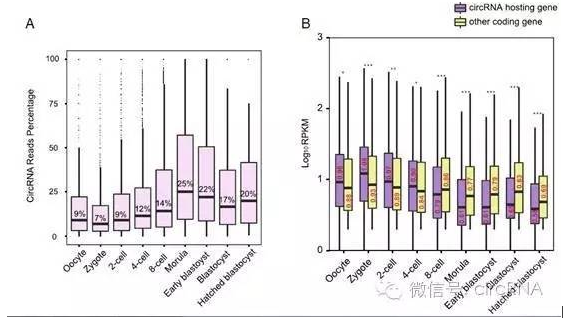 图2 circRNA表达丰度变化情况 (来自(Dang et al., 2016))
图2 circRNA表达丰度变化情况 (来自(Dang et al., 2016))
不同遗传来源的circRNA表达特征:
作者将circRNA对应的hosting gene的遗传来源不同,分为母系背景的基因(maternal gene)和合子表达基因(zygotic gene)。作者共鉴定到1554个maternal gene,851个zygotic gene。另有569个基因不好确定具体的遗传来源。作者按照发育阶段分别分析了maternal gene和zygotic gene对应的circRNA与线性RNA的表达比例(CLR),发现八细胞期之前,maternal gene来源的circRNA表达偏多,而八细胞期之后zygotic gene来源的circRNA表达明显增高。
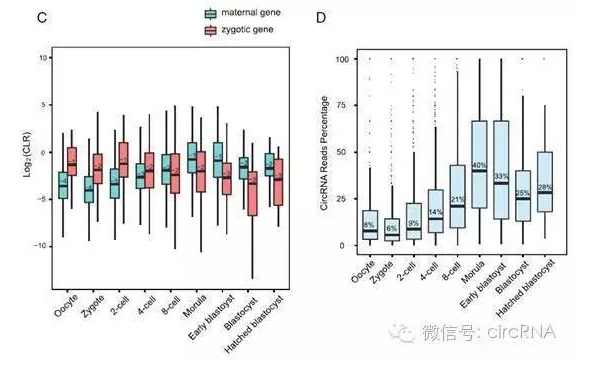 图3 不同circRNA表达变化情况(来自(Dang et al., 2016))
图3 不同circRNA表达变化情况(来自(Dang et al., 2016))
人类与小鼠胚胎发育中circRNA表达异同:
作者之前曾报道研究了小鼠胚胎发育相关的circRNA表达情况。与本文的研究结果比较后发现,人类和小鼠共有835个hosting基因是吻合的,人类特有的为2139种,小鼠特有的为481种。
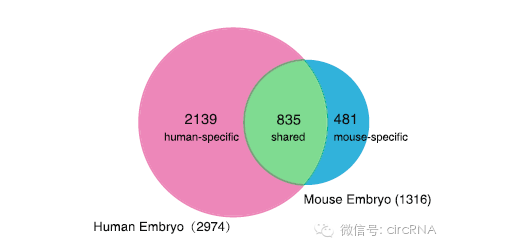
图4 人类与小鼠circRNA hosting基因比较 (来自(Dang et al., 2016))
作者还针对2974个circRNA hosting gene进行了通路分析,汇总为10种不同的细胞通路。在胚胎发育早期,circRNA hosting gene通常为细胞器结构调控,染色质结构调控及转录调控通路的基因。
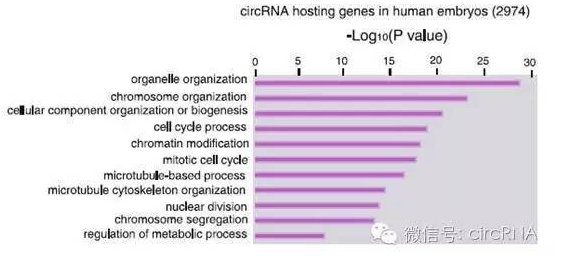
图5 人类circRNA hosting基因通路分析 (来自(Dang et al., 2016))
本工作的创新点与意义:
本文的首次系统分析了人类胚胎着床前不同阶段环状RNA的表达情况,在之前报道的PolyA+ RNA研究的基础上,丰富了PolyA— RNA在人类胚胎发育过程中的认识。为增进人类胚胎发育机制的认识以及circRNA参与调控的复杂机制相关的研究提供了宝贵的资源。
通讯作者主要工作方向介绍:
(来自北京大学生物动态光学成像中心介绍资料)
黄岩谊:北京大学生物动态光学成像中心研究员,课题组致力于发展应用于集成生物学研究的新技术。课题组当前的研究兴趣集中在基因测序技术、微流控技术及生物成像技术三个方面。我们一直在发展高效、新型的高通量DNA测序技术及其应用方法,特别是测序化学与设备研发、单细胞测序技术应用与器件研发、以及少量细胞的表观基因组学测序方法研发。我们同时大力发展大规模集成微流控芯片技术,并将其应用在生命科学关键问题的研究中,包括细胞培养及微环境控制,以及在单细胞层次上观察生命过程的随机性。我们还大力发展新的生物成像技术及图像处理算法,用于研究细胞及活生物体的动态过程。我们利用相干拉曼散射显微技术,可以无需标记来研究活生物体和活细胞内的三维化学成像,同时利用这样的技术来促进药物释放及癌症诊断的研究。
汤富酬:北京大学生物动态光学成像中心研究员,课题组主要致力于研究具有自我更新能力和分化潜能的干细胞是哺乳动物胚胎发育过程中以及成体中的关键种类的细胞,对各种干细胞进行深入研究是理解哺乳动物发育、生长机制的关键,也是将干细胞应用于临床再生医学、治疗人类疾病的前提。本实验室主要围绕哺乳动物早期胚胎发育研究多能性干细胞分化、发育调控的分子机理,特别是表观遗传学调控机理,以及相关的原始生殖细胞(Primordial Germ cells)发育过程中的表观遗传学重编程机理。利用我们发展的单细胞转录组测序技术(single cell RNA-Seq transcriptome analysis)、单细胞DNA甲基化组分析技术(Single cell RRBS),以及单细胞基因组测序技术(Single cell genome sequencing)、染色体免疫共沉淀-测序技术(ChIP-Seq)、早期胚胎显微操作技术深入分析哺乳动物早期胚胎以及多能性干细胞中基因表达网络的表观遗传学调控机理。
乔杰:北京大学第三医院生殖医学中心主任,主要研究方向包括:以生殖调控相关的基础研究和不孕症相关疾病发病机制及诊疗新技术的研发为核心,在发现调控人类胚胎发育过程的关键基因、创建新型卵母细胞体外成熟体系和提高疑难不孕患者治疗成功率等方面做出突出贡献:1、建立人类精卵遗传图谱及胚胎早期发育基因表达谱,明确调节胚胎发育关键基因;开发新型体外生殖细胞培养体系和微流控芯片精子筛选技术;2、发现炎症因子影响卵母细胞质量导致不孕新机制,创立子宫内膜容受性评估和治疗新方法,改进卵母细胞及胚胎冻存技术,显著提高妊娠成功率;3、发现多囊卵巢综合征(PCOS)发病炎性机制,建立其代谢异常预测模型,提供预防其长期合并症的新策略,制定适用于中国PCOS的诊断标准。
参考文献:
Dang, Y., Yan, L., Hu, B., Fan, X., Ren, Y., Li, R., Lian, Y., Yan, J., Li, Q., Zhang, Y., et al. (2016). Tracing the expression of circular RNAs in human pre-implantation embryos. Genome biology 17, 130.
Fan, X., Zhang, X., Wu, X., Guo, H., Hu, Y., Tang, F., and Huang, Y. (2015). Single-cell RNA-seq transcriptome analysis of linear and circular RNAs in mouse preimplantation embryos. Genome biology 16, 148.
北京大学生物动态光学成像中心:http://biopic.pku.edu.cn/index.aspx
北京大学第三附属医院乔杰:http://puh3.net.cn/szyxzx/zjjs/29171.shtml





来第一个抢占沙发评论吧!