文章来源:中华糖尿病杂志,2020,12 (03): 189-192
作者:张静静 叶阳 魏丽
单位:上海海洋大学 上海健康医学院附属第六人民医院
摘要
环状RNA(circRNAs)是一种内源性共价闭合环形RNA分子,具备特异性、高稳定性和高丰度的特点,是一种新型基因表达调控分子。circRNAs参与多种疾病发展,目前发现与糖尿病、动脉粥样硬化、心血管疾病、神经系统疾病和癌症等疾病密切相关。其作用机制的研究有助于开发新型诊断标志物、探讨疾病发病机制、寻找有效的治疗靶点。本文综述了circRNAs的特征、功能以及在糖尿病及其并发症中的最新研究进展,以期为进一步的circRNAs研究提供参考。
据国际糖尿病联盟统计,2017年全世界约有4.51亿糖尿病患者,到2045年,人数可能增加到6.93亿[1],糖尿病及其各种并发症严重威胁人类健康。已经证实某些环状RNA(circular RNA,circRNAs)在糖尿病患者和健康受试者外周血中的表达水平有显著差异[2],circRNAs可调节β细胞功能,影响胰岛素分泌[3]。进一步探索circRNAs在糖尿病中扮演的角色,可更好地了解疾病发生机制,提高诊疗水平。
一、circRNAs的生物学特征及调控机制
1971年,科学家在研究马铃薯纺锤块茎病时首次发现单链闭合的RNA分子[4]。随后,陆续有研究者发现环状转录物的存在,Memczak等[5]利用RNA-seq分析鉴定出1 950种人类circRNAs,1 903种小鼠circRNAs及724种线虫circRNAs,并证明circRNAs是一种转录后调节器。circRNAs由mRNA前体(pre-mRNA)反向剪接形成,无5′端帽子和3′端polyA尾,不易被RNA外切酶切割,具有更长的半衰期,据序列特征可分为三类:外显子circRNAs(exoniccirc RNAs,ecRNA)、内含子circRNAs(circular intronic RNA,ciRNA)、外显子-内含子circRNAs(exon-intron circRNAs,EIciRNA)。
细胞中circRNAs的稳定表达与三个层面的调控相关。其一,circRNAs的形成与RNA聚合酶Ⅱ(RNA polymerase Ⅱ,Pol Ⅱ)的延伸效率正相关[6]。其二,顺式元件如内含子中倒置重复的Alu元件、核心剪接体元件、RNA结合蛋白及反式调节因子影响反向剪接效率:Alu元件促进外显子的反向剪接[7];circRNAs形成需要剪接体来装配[8];RNA结合蛋白可将剪接位点连接在一起促进反向剪接[9]。另外,环状RNA的降解与生成之间的平衡也影响其表达。
二、circRNAs的功能
1.充当microRNAs海绵:
circRNAs作为microRNAs的竞争性内源RNA,发挥microRNAs运载体的功能,抑制microRNAs的翻译抑制功能。小脑变性相关蛋白1反义转录物(CDR1 antisense RNA,CDR1as)含74个miR-7结合位点,CDR1as过表达,限制miR-7活性,导致miR-7靶基因表达增加,而敲减CDR1as,miR-7靶基因表达降低[5]。
2.调控基因表达:
细胞核中的EIciRNA可与U1小核糖核蛋白相互作用促进基因转录。来源于锚蛋白重复结构域52基因内含子的环状RNA(ci-ankrd52)促进其亲本基因ANKRD52的转录[10]。另外,circRNAs的形成会对pre-mRNA的线性剪接过程形成竞争,影响mRNA的表达。
3.与RNA结合蛋白(RNA-binding protein,RBP)相互作用:
circRNAs-蛋白相互作用过程调控彼此的功能。一方面,circRNAs与AGO蛋白(argonaute proteins)、含有KH结构域的RNA结合蛋白(RNA QKI)、肌肉样拼接调节器(MBL)、Pol Ⅱ等形成稳定结构,动态调控circRNAs的形成[11,12]。另一方面,circRNAs-蛋白相互作用调控相关蛋白功能。例如,circ-FOXO3与细胞周期蛋白依赖性激酶2(cyclin dependent kinase 2,CDK2)和细胞周期蛋白依赖性激酶抑制剂1A(cyclin dependent kinase inhibitor 1A,p21)结合,促进p21对CDK2的抑制作用,参与细胞周期的调控[12]。
4.作为蛋白质/肽翻译的模板:
某些circRNAs具有内部核糖体进入位点(internal ribosome entry sites,IRESs),可编码蛋白质。Circ-ZNF609翻译产生参与肌肉形成的蛋白[13]。胶质母细胞瘤中的circ-FBXW7编码一种新蛋白可抑制癌细胞增殖和细胞周期加速[14]。
三、circRNAs与糖尿病及其并发症
1.作为糖尿病的诊断标志物:
Zhao等[2]对2型糖尿病(type 2 diabetes mellitus,T2DM)患者外周血中的circRNAs进行微阵列分析,发现hsa_circ_0054633具有最大的受试者工作特征曲线下面积(area under curve,AUC),诊断糖尿病前期和T2DM的AUC分别为0.841[(0.773~0.910),P<0.001]、0.834[(0.762~0.905),P<0.001]。妊娠期糖尿病中hsa_circ_0054633与母体糖化血红蛋白水平高度相关(P<0.05),在妊娠中期、晚期、胎盘和脐带血中显示出诊断价值(AUC分别为0.793、0.664、0.774和0.783,P<0.001)[15]。本实验室前期通过芯片分析T2DM患者外周血中差异表达的circRNAs,验证发现hsa-circ-000094在正常对照、糖调节异常(IGR)和T2DM样本中表达呈明显上升趋势,其用于诊断IGR、T2DM的AUC分别为0.673 3[(0.575 7~0.771 0),P<0.01]、0.723 1[(0.632 7~0.813 4),P<0.01][16]。测序技术的发展为筛选差异表达的circRNAs提供了便利,科研人员需进一步进行大样本验证,以寻找特异性、敏感性高的诊断标志物。
2.在糖尿病中的作用:
miR-7抑制胰岛β细胞增殖和胰岛素分泌,CDR1as可作为miR-7的海绵,阻断miR-7对哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的抑制,促进胰腺β-细胞增殖[17]。盒蛋白(paired box 6,Pax6)促进胰岛素相关基因转录,肌球蛋白VIIA与Rab相互作用蛋白(myosin VIIA and Rab interacting protein,Myrip)与包含胰岛素的囊泡结合,协助胰岛素转运,CDR1as可阻断miR-7对Pax6和Myrip的抑制作用,促进胰岛素分泌。长期的毛喉素及醋酸苯汞刺激影响环腺苷酸(cyclic adenosine monophosphate,cAMP)信号通路及磷脂肌醇信号途径(protein kinase C system,PKC),上调CDR1as,显著增加胰岛素分泌。db/db小鼠胰岛中circHIPK3和CDR1as表达减少,转录组学数据显示,circHIPK3通过抑制miR-124-3p、miR-338-3p的活性,调控丝氨酸苏氨酸蛋白激酶1(AKT serine/threonine kinase 1,Akt1)、葡萄糖转运体2(solute carrier family 2,Slc2a2)和肌营养因子(myotrophin,Mtpn)的表达从而影响β细胞增殖、β细胞的葡萄糖摄取及胰岛素合成、分泌过程。
3.在糖尿病并发症中的作用:
糖尿病患者体内长期高血糖环境会影响血管、神经、心脏、肾脏、眼睛等,造成多种并发症,严重影响患者生活质量。
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病最常发生的并发症之一。Gu等[18]分析DR患者血清中的circRNA,发现了30个显著上调的circRNA。Pan等[19]发现,高糖培养的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中hsa_circ_0054633表达增加,并抑制miR-218的活性,阻断miR-218对环形交叉轴突导向受体同源物1和血红素加氧酶1的抑制作用,在内皮细胞功能障碍中起保护作用。circ_0005015在DR患者的血浆、玻璃体和纤维血管膜中上调,其充当miR-519d-3p海绵,抑制miR-519d-3p活性,导致基质金属蛋白酶2、X连锁凋亡抑制蛋白和信号转导转录激活因子3(signal transducer and activator of transcription 3,STAT3)表达增加,从而调节内皮细胞增殖、迁移和基质胶管形成,促进视网膜内皮血管生成[20]。
高糖条件下内皮细胞功能障碍引发糖尿病相关心血管并发症[21],高糖诱导的血管平滑肌细胞中,上调的circWDR77通过miR-124作用于成纤维细胞生长因子2,促进血管平滑肌细胞增殖和迁移[22]。circRNA cZNF609在糖尿病小鼠视网膜血管细胞及高糖培养的HUVECs中上调,而cZNF609沉默可抑制病理性血管生成且保护内皮细胞免受氧化应激和缺氧应激损伤[23]。Tang等[24]发现糖尿病小鼠心肌中的circRNA_000203表达显著增加,circRNA_000203阻断miR-26b-5p对心脏纤维化相关基因Col1a2、Col3a1、α-SMA及CTGF的抑制作用,促进心脏纤维化。
肥胖、胰岛素抵抗、T2DM、炎症、非酒精性脂肪性肝病(NAFLD)、高血压和动脉粥样硬化等代谢疾病多相伴发生。肥胖症中,促炎性脂肪因子增加引发炎症,炎症途径干扰胰岛素信号传导导致脂肪细胞、肝细胞和肌肉细胞中葡萄糖代谢受损,引发T2DM。miR-103通过抑制线粒体自噬加重炎症,circARF3可阻断miR-103的效应,导致肿瘤坏死因子受体相关因子3(TNF receptor associated factor 3,TRAF3)表达增加,TRAF3抑制核因子κB(nuclear factor kappa-B,NF-κB)信号通路,增强线粒体自噬,抑制Nod样受体蛋白3(NOD-like receptor pyrin domain containing 3,NLRP3)炎症小体激活[25]。胰岛素抵抗是T2DM和NAFLD的共同发病机制,NAFLD与T2DM密切伴随互为因果。Jin等[26]筛选NASH小鼠肝脏circRNA表达谱,与对照组相比NASH组有69个上调及63个下调的circRNAs,生物信息学分析及qPCR验证建立了circRNA_002581-miR-122-Slc1a5、circRNA_002581-miR-122-Plp2、circRNA_002581-miR-122- Cpeb1和circRNA_007585-miR-326-UCP2四种circRNA- miRNA-mRNA途径,为NASH发病机制研究提供新的方向。游离脂肪酸诱导的肝细胞脂肪变性模型中circRNA_0046366表达量降低,研究表明circRNA_0046366拮抗miR-34a的活性,过表达circRNA_0046366可消除miR-34a对过氧化物酶体增殖物激活受体α的抑制,促进脂代谢相关基因CPT1A、SLC27A的转录,从而改善肝脂肪细胞变性表型[27]。
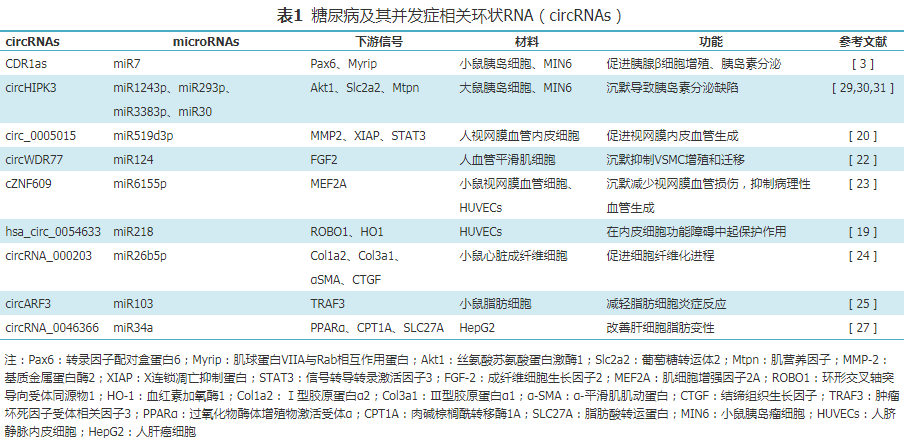
伤口愈合受损一直是糖尿病及糖尿病并发症患者面临的问题。近期研究[28]表明circ-Amotl1可加速小鼠伤口愈合,circ-Amotl1和STAT3特异性结合,促进STAT3的核转位,STAT3通过结合DNA甲基转移酶3A(DNA methyltransferase 3 alpha,DNMT3A)的启动子促进其转录,同时DNMT3A诱导miR-17启动子的甲基化,抑制miR-17-5p表达,使miR-17-5p靶标蛋白(STAT3、DNMT3A、fibronectin)表达增加,从而促进细胞增殖、存活、黏附及迁移,加快伤口修复。下表是对糖尿病及其并发症相关circRNAs的简要总结,供研究人员参考(表1)。
四、问题与展望
circRNAs在糖尿病发病或糖尿病早期患者体内已有改变,但不可否认大多数circRNAs可能仅是细胞耐受而产生的无功能转录副产物,需对circRNA进行全面的功能研究,确认circRNAs差异表达具体机制及参与基因表达调控的具体方式。如在糖尿病相关circRNAs研究中,需明确circRNAs作用于哪些器官,是否影响胰岛细胞活性、胰岛素分泌、糖脂代谢及胰岛素抵抗等过程。circRNAs可从病变组织或器官释放到血液或尿液中,血清中circRNA主要来自外泌体,不含外泌体的血清中,circRNAs含量降低,另外,血细胞特别是血小板中含有大量的circRNAs,故不同的采血方式(全血、血清、血浆),会影响circRNAs的定量。总之,样本的采集、储存、处理、分析方式都会对circRNAs的定量分析造成干扰。目前,糖尿病相关的circRNAs研究多集中在诊断标志物的筛选及初步功能验证,关于样品收集处理方式如何影响circRNAs定量的研究还很少。建立标准化的样品处理和分析方式是保证诊断标志物稳定性、准确性的前提。人类对非编码RNA库的认知还很浅,具有特殊结构的circRNA值得我们去探索,circRNA基因表达调控功能的研究可为人工合成小分子RNA药物提供依据。




来第一个抢占沙发评论吧!