Expression profiles of circRNAs and the potential diagnostic value of serum circMARK3 in human acute Stanford type A aortic dissection
circRNAs的表达谱和血清circMARK3在急性StanfordA型主动脉夹层中的潜在诊断价值
发表单位:南京大学医学院附属鼓楼医院
该项研究主要探究了AAAD相关的血清标志物circRNA,文章大体内容如下:
CircRNA参与多种人类疾病,但是,circRNA在人类急性Stanford A型主动脉夹层(AAAD)中的表达谱和潜在诊断价值仍然未知。在这项研究中,高通量RNA测序(RNA-Seq)用于研究人AAAD组织(n = 10)与正常主动脉组织(n = 10)中差异表达的circRNA,microRNA(miRs)和mRNA。RNA-Seq的结果显示506个circRNA被显着失调(P <0.05,FDR <0.05,倍数变化> 2)。随后的加权基因相关网络分析和随后的共表达网络分析表明,酪氨酸蛋白激酶Fgr在AAAD的发生和发展中可能起重要作用。根据circRNA-miRNA-mRNA网络,我们发现Fgr的上游调节分子是circMARK3。最后,使用ROC曲线评估血清circMARK3的诊断价值,作为AAAD的生物标志物(临界值= 1.497,曲线下面积= 0.9344,P <0.0001,灵敏度= 90.0%,特异性= 86.7%)。这些结果提供了circRNAs表达谱的初步概况,并表明circMARK3是AAAD诊断的潜在生物标志物。
前 言
急性斯坦福A型主动脉夹层(AAAD)是最危险的血管疾病之一,其特征是主动脉壁撕裂,一旦发生,死亡率将非常高。尽管导致主动脉内侧变性的主要机制是细胞外基质降解,平滑肌细胞凋亡和表型转换和发炎,但主动脉夹层的确切触发机制尚不清楚。
在这项研究中,我们使用RNA-Seq分析筛选了AAAD的circRNAs表达谱。进行生物信息学分析以预测差异表达的circRNA的潜在生物功能(AAAD与对照)。酪氨酸蛋白激酶Fgr被认为在AAAD的发展中起着重要作用,其参与细胞外刺激后将细胞外信号传递到细胞中,调节免疫应答和炎性因子的释放,并假定其上游调节剂血清circMARK3。具有潜在的诊断价值。
结 果
1、 circRNA的表达谱
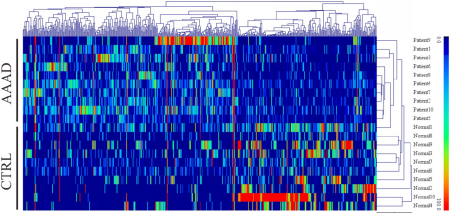
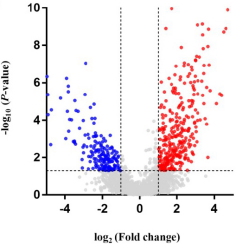
RNA-Seq检测到总共2935个circRNA,其中506个circRNA失调(P <0.05,FDR <0.05,倍数变化<0.5或> 2)。与对照组相比,AAAD组中有320个circRNA显着上调,有186个circRNA显着下调。分层聚类和火山图显示了AAAD与正常主动脉组织之间circRNA的表达谱。在所有明显失调的circRNA中,外显子型为88.3%,内含子型为4.5%,有义重叠型为6.3%,基因间型为左0.8%。(注:使用10对疾病和对照样品进行RNA-seq测序分析,鉴定其中的差异表达circRNA,使用热图和火山图并概述差异circRNA的基因组位置等信息)
图 所有circRNA的层次聚类分析。506个circRNAs在人AAAD组织和正常主动脉组织中有显著差异(P<0.05,FDR<0.05,折叠变化>2)。其中在AAAD组织中上调了320个circRNAs,下调了186个circRNAs。
图 火山图显示了差异表达的circRNA。蓝色和红色部分显示AAAD组织中失调的circRNAs表达分别减少和增加了2倍以上(P<0.05)。
选择在RNA-Seq分析中鉴定出的前10个显着差异表达的circRNA,miR和mRNA用于进一步的qRT-PCR分析,使用了30种匹配的人AAAD和正常主动脉组织,通过qRT-PCR的结果证实了差异基因的表达差异。(注:挑选差异表达倍数最大的基因通过qPCR进行验证)
2 、CircRNA-miRNA-mRNA相互作用网络
为了进一步研究差异表达的circRNA作为miRNA海绵的功能,一起分析了差异表达的circRNA,miR和mRNA,以构建circRNA-miRNA-mRNA相互作用网络。AAAD组中有678个差异表达的circRNA的靶基因显着失调,其中326个基因显着上调,而352个基因显着下调。(注:通过表达差异的相关性和互作预测分析,作者筛选出差异circRNA、miRNA和mRNA之间的相互作用关系)
3 、差异表达circRNAs靶基因的生物信息学分析
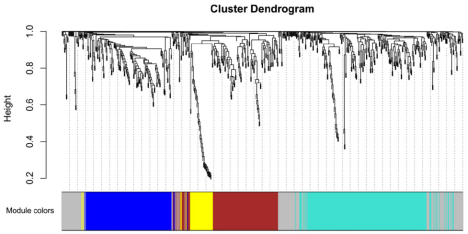
在生物过程,细胞成分和分子功能类别中,最丰富的GO术语分别是消化道发育,受体复合物和血小板衍生的生长因子受体结合。KEGG通路富集分析的结果表明,差异表达的circRNA的靶基因主要参与p53信号传导途径,Ras信号传导途径,钙信号传导途径以及细胞衰老。基因集富集分析(GSEA)的结果表明,目标基因主要富集于细胞周期,细胞死亡,细胞组分拆卸,对DNA损伤刺激的反应,经典Wnt信号通路的调控以及对应激反应的调控。对差异表达的circRNA的靶基因进行加权基因共表达网络(WGCNA)分析,将678个差异表达的基因聚集成5个模块。以下模块特征关系分析显示,灰色模块与AAAD密切相关,酪氨酸蛋白激酶Fgr是灰基因模块中的核心基因。RNAhybrid程序预测了Fgr与其靶向miR的结合以及miR与circRNA靶向的mfe,结果表明Fgr的上游circRNA是circMARK3。(注:分析差异表达circRNA的靶基因的功能,富集到与疾病相关的通路,并筛选出关键的中心circRNA和mRNA)
图 差异表达circRNAs靶基因的加权基因相关网络分析(WGCNA)。差异表达circRNAs靶基因的层次聚类树状图及各模块的颜色分配。
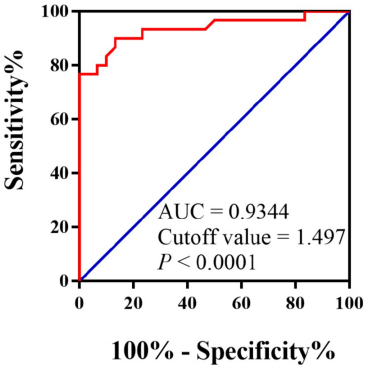
4 、患者血清circMARK3的ROC曲线分析
AAAD患者血清中circMARK3表达上调,为了评估血清circMARK3在AAAD中的诊断价值,构建了ROC曲线,结果显示AUC为0.9344。因此,circMARK3可以作为AAAD诊断的潜在生物标记。MiR通常被用作人类疾病的生物标记,我们进一步评估了血清circMARK3和miR-1273-3p的组合的诊断价值。结果表明,circMARK3和miR-1273-3p组合的AUC为0.9644,circMARK3和miR-1273-3p的组合可提高可预测性。在独立的患者队列中也验证了血清circMARK3的诊断价值以及血清circMARK3和miR-1273-3p的组合。(注:在血清样品中验证中心circRNA及其靶标mRNA的诊断价值,通过ROC分析验证了两者的组合有较高的诊断价值)
图 血清circMARK3对AAAD的诊断价值分析。受试者操作特性(ROC)曲线显示血清circMARK3对AAAD的诊断价值(AUC=0.9344,P<0.0001)。
讨 论
总之,这项研究提供了AAAD中circRNAs表达谱的概况,并表明circMARK3是诊断AAAD的潜在生物标记。生物信息学分析预测差异表达的circRNA的潜在功能。进一步的机制和功能研究将有助于更深入地了解AAAD的病理过程,并为临床诊断和治疗找到新的特定分子靶标。
材料方法
鉴定差异表达的circRNA,miR和mRNA
DE-Seq算法用于过滤差异表达的circRNA,miR和mRNA。根据倍数变化(<0.5或> 2.0),显着性分析(P <0.05)和错误发现率(FDR;P <0.05)分析,选择差异表达的circRNA,miR和mRNA进行进一步的研究。
生物信息学分析
一起分析差异表达的(AAAD与对照)circRNA,miRs和mRNA,以构建circRNA-miRNA-mRNA相互作用网络。通过RNAhybrid程序计算miR与其靶向序列结合的碱基配对和最小自由能(mfe)。共表达网络是使用Cytoscape软件绘制的。
使用R中的Bioconductor中的clusterProfiler,针对差异表达的circRNA的目标基因进行了基因本体论(GO)分析和《京都议定书》。富集阈值为P <0.05,基因计数≥2。
进行基因集富集分析(GSEA),并通过GSEA(3.0版)生成图。它用于鉴定具有统计学上显着富集的功能相关基因组(基因集)的上调或下调。
通过WGCNA软件包使用R进行加权基因共表达网络分析(WGCNA)。将差异表达的circRNA的靶基因输入到WGCNA。使用WGCNA R软件包中的pickSoftThreshold函数,用于构造WGCNA邻接矩阵的软阈值计算能力为16。使用WGCNA R软件包中的blockwiseModules函数构造了一个带符号的网络。设置了30个基因的最小模块大小。所有其他参数均设置为默认值。在网络构建之后,使用WGCNA R软件包中的moduleEigengenes函数计算模块特征基因。通过确定模块本征基因和性状之间的皮尔逊相关性来评估模块-性状关系。使用WGCNA R软件包中的corPvalueFisher函数确定每个相关性的重要性。




来第一个抢占沙发评论吧!