论文标题:m6A Modification in Coding and Non-coding RNAs:Roles and Therapeutic Implications in Cancer
刊登日期:2020年03月
发表杂志:Cancer Cell
影响因子:23.916
研究机构:希望之城医学中心贝克曼研究所陈建军课题组
摘要
RNA甲基化修饰m6A是近年来出现的一种控制真核细胞基因表达的新的调控机制。作为一种可逆的表观遗传修饰,m6A不仅存在于信使RNA中,还存在于非编码RNA中,影响修饰RNA分子的命运,并在几乎所有重要的生物过程中发挥重要作用,包括癌症的发生。
本文整理描述了编码和非编码RNA中的m6A修饰在肿瘤发病机制和药物反应/耐药中的病理作用和潜在的分子机制的最新研究成果,并讨论了靶向m6A调控因子在癌症治疗中的潜在治疗潜力。在此我们对编码和非编码RNA中的m6A修饰在肿瘤发病机制和药物反应/耐药中近几年的研究成果进行了整理,撰写此综述。
1、RNA上m6A修饰的调控和功能
1.1 真核RNA中的m6A修饰
由核苷和磷酸基团组成的核苷酸是DNA和RNA的基本分子结构。自1950年代以来,已经发现RNA中对腺苷(A),鸟苷(G),胞苷(C)和尿苷(U)核苷的化学修饰数量还在不断增加,这增加了我们对RNA世界理解的复杂性、RNA的生物发生和功能。m6A是位于N6位的甲基化腺苷,在信使RNA(mRNA)和非编码RNA(ncRNA)中是一种广泛而丰富的修饰,并且是迄今为止研究充分的RNA修饰之一。自1970年代首次发现以来,m6A被确定为包括哺乳动物在内的大多数真核生物中最普遍的mRNA内部修饰。然而,由于缺乏从全面研究转录组中m6A修饰的生化工具,该领域在几十年中没有取得太大进展。
2011年将脂肪和肥胖相关蛋白(FTO)鉴定为第一个m6A脱甲基酶,表明m6A修饰是可逆的和动态的,因此可能在功能上很重要(m6A去甲基化酶FTO的难产之路 | m6A八卦故事)。从那时起,几乎所有主要生物过程,正常发育和疾病(包括癌症)中都报道了m6A修饰的功能重要性。转录组中层面的m6A整体修饰水平的鉴定首先在2012年分别有来自以色列特拉维夫大学和美国康奈尔大学医院的两个课题组独立将相关结果发表了Nature和Cell上。
这2篇文章表明在大约三分之一的哺乳动物mRNA中鉴定出了m6A,每个mRNA平均有3-5个m6A修饰,并且在人与小鼠之间许多m6A位点发生了进化。转录组中m6A修饰的分布不是随机的。m6A修饰位点具有典型的共有序列DRACH(D=G,A或U;R=G或A;H=A,C或U),并且富含编码序列(CDS)和未翻译的3’区域(3’UTR),在终止密码子区域附近具有特别高的富集度。到目前为止,几种抗体依赖性的测序方法如只能进行区域内peak calling的m6A-seq,m6A单个核苷酸分辨率的交联和免疫沉淀miCLIP-seq。
另外一种不依赖抗体的方法,甚至可以达到单碱基水平的测序方法同时出现在2019年。如以色列魏茨曼科学研究学院Schraga Schwartz课题组开发的MAZTER-seq发表在了Cell上。而来自中山大学的骆观正教授团队开发的m6A-REF-seq也有异曲同工之妙,利用MazF酶的方式达到单碱基的分辨率,这项研究发表在了Science Advanced。另外在2019年9月,来自美国杜克大学医学院的Kate D. Meye同时也是2012年第一篇MeRIP-seq技术开发的第一作者,在Nature Methods发表文章开发了全新的DART-seq,这种方法利用APOBEC1-YTH融合蛋白识别m6A位点,并介导胞嘧啶到尿嘧啶的编辑(C-to-U),从而检测m6A位点的非抗体依赖的m6A鉴定方法,这使得在多种细胞环境下高分辨率检测整体转录水平的m6A修饰成为可能。这种基于NGS的方法的出现使我们对这种表观遗传标记有了更深入的了解。现在已经清楚的是,几乎所有类型的RNA上都存在m6A,包括mRNA,核糖体RNA(rRNA),长非编码RNA(lncRNA),microRNA(miRNA),小核RNA(snRNA)和环状RNA(circRNA)),并在包括肿瘤发生在内的许多生理和病理过程中受到动态调节。
1.2 由Writers和Erasers动态调节m6A修饰
图1. mRNA中可逆化的m6A修饰. 驻留在mRNA中的A碱基可以通过由METTL3-METTL14-WTAP核心组件和其他调节性辅因子组成的大型MTC甲基转移酶复合物或单独由METTL16甲基化以形成m6A。该酶促反应使用S-腺苷甲硫氨酸(SAM)作为甲基供体。m6A可以被m6A阅读蛋白识别以影响mRNA的命运,或者可以被m6A去甲基化酶(即FTO和ALKBH5)可逆地去甲基化修饰。去甲基过程需要α-酮戊二酸(α-KG)和O2作为共底物,亚铁(Fe2+)作为辅因子。
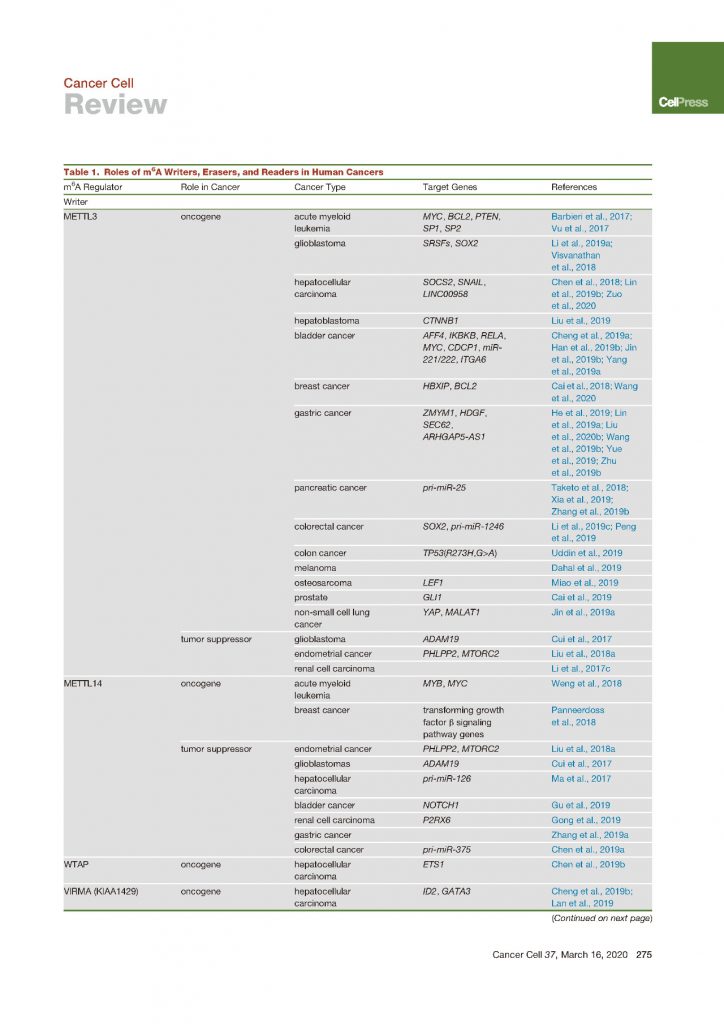
与DNA和蛋白质相似之处在于,RNA可以分别通过专用的甲基转移酶(也称为Writers)和脱甲基酶(也称为Erasers)进行甲基化和去甲基化处理。作为第一个已知的可逆mRNA修饰,m6A已成为上转录组学领域的主要关注点,并且已鉴定出一大堆m6A的甲基化转移酶和脱甲基化酶。
m6A修饰物在mRNA中的沉积是由多组分m6A甲基转移酶复合物(MTC)执行的,该复合物由核心成分,甲基转移酶样3(METTL3)/甲基转移酶样14(METTL14)异二聚体和其他调控因子组成,包括WTAP、KIAA1429、ZC3H13和RBM15/RBM15B。在该复合物中,METTL3是与甲基供体S-腺苷甲硫氨酸(SAM)结合并催化甲基转移的唯一催化亚基,而METTL14通过稳定METTL3构象并识别底物RNA对m6A沉积至关重要。
最近据报道,METTL14可以识别组蛋白H3赖氨酸36三甲基化(H3K36me3)修饰并介导m6A在mRNA中的沉积选择性。与H3K36me3在通用m6A修饰中的调节作用不同,某些转录因子可以通过募集或排斥MTC在某些特殊细胞环境中调节某些mRNA中的m6A沉积。尽管MTC催化了poly(A)RNA中的大多数m6A甲基化,但是甲基转移酶样16(METTL16),含锌指CCHC型的4(ZCCHC4)和甲基转移酶样5(METTL5)也被确定为m6A甲基转移酶。可以单独发挥作用并在某些结构化的RNA上催化m6A。
RNA的m6A修饰可通过α-酮戊二酸(αKG)依赖性和Fe(II)依赖性脱甲基酶去除,特别是FTO和alkB同源物5(ALKBH5),因此赋予了生理和病理条件下m6A甲基化的动态调节。作为首次报道的m6A人脱甲基酶,何川教授课题组发现FTO可以介导mRNA中内部m6A和5’帽m6Am(N6,2′-O-二甲基腺苷)的去甲基化。然而迄今为止,在许多研究的细胞类型中,mRNA中的内部m6A是FTO的主要底物,包括急性髓细胞白血病(AML)细胞(m6A去甲基化酶FTO对急性骨髓白血病有致癌作用)。FTO通过促进AML细胞的增殖和抑制分化而发挥致癌作用,其中FTO在细胞质中广泛表达并在mRNA中使细胞质m6A显着去甲基化,从而将FTO的致癌功能与其细胞质m6A脱甲基化活性联系起来。在其他情况下,FTO在细胞核内的功能性作用仍需要通过其他研究来解决。与FTO不同,ALKBH5似乎是m6A特异的脱甲基酶。
Writers和Erasers对于在整个人体组织和细胞中维持适当的m6A水平和基因表达非常重要。m6A修饰物的沉积和去除之间的动态平衡对于正常的生物过程和开发至关重要。因此,通过在具有关键生物学功能的RNA转录物中异常添加或去除m6A,Writers和Erasers上发生的突变或失调通常与疾病(例如癌症)有关。如METTL14上一旦关键domain区域的碱基发生突变后,会影响子宫内膜癌后期发生的进展。
1.3 m6A在mRNA命运决定中的多功能性
图2. mRNA和ncRNA中m6A的功能。m6A修饰共转录沉积在新生的mRNA中,然后通过将剪接因子募集到m6A位点或侧翼序列进行选择性剪接。剪接后,YTHDC1识别含m6A的mRNA,并将其输出到细胞质中。成熟mRNA上5’ UTR存在m6A修饰会影响mRNA稳定性,其中IGF2BP1/2/3蛋白作用是稳定,而YTHDF2/3蛋白的作用则相反使mRNA更容易降解。lncRNA上的m6A修饰在RNA-RNA相互作用、RNA-蛋白质相互作用和染色质重塑中起作用。反义lncRNAs可以通过募集去甲基化酶如ALKBH5来调节其互补的正义链mRNA上的m6A修饰。pri-miRNA上m6A修饰有助于生成成熟体miRNA。circRNA上的m6A修饰可以促进翻译蛋白质,或抑制circRNA免疫相关功能。
基因表达被严格控制在不同的水平,包括转录,转录后,翻译和翻译后。m6A在转录过程中沉积在天然RNA转录物上,并通过改变RNA结构或m6A结合蛋白(也称为reader)的特异性识别,在转录后影响基因表达。
m6A的Writers和Erasers位于细胞核中,它们与mRNA剪接因子相关,暗示m6A与mRNA剪接具有功能相关性。实际上,前体mRNA(pre-mRNA)上的m6A修饰可以募集hnRNPA2B1(m6A识别酶HNRNPA2B1介导RNA加工),或通过改变局部结构来增加侧翼RNA序列与剪接因子异质核糖核蛋白C(hnRNPC)和hnRNPG的可及性,这是一种称为“m6A开关”的机制。
另一方面,m6A也可能与阅读器蛋白YTHDC1结合,该蛋白募集剪接因子SRSF3,但排斥SRSF10以促进外显子包含在靶向mRNA中起作用(m6A阅读蛋白YTHDC1调控mRNA可变剪切)。YTHDC1还影响m6A修饰的mRNA转录物从核到细胞质的输出(YTHDC1调控m6A修饰mRNA出核转运)。
细胞质RNA可以加载到核糖体上进行主动翻译,也可以分选到信使核糖核蛋白(mRNP)焦点上,例如加工体(P-body)和应激颗粒,以进行降解或存储。包含YT521-B同源(YTH)域的家族蛋白YTHDFs倾向于加速细胞质中m6A修饰的mRNA的代谢。
YTHDF1选择性识别m6A并与起始因子eIF3相互作用以促进翻译起始和蛋白质合成。相反,YTHDF2将m6A修饰的可翻译mRNA带到mRNA衰变位点(例如P体),并募集CCR4-NOT腺苷酸酶复合物以触发转录本的腺苷酸化和降解。YTHDF3的功能比较特殊,当与YTHDF1协同时促进mRNA的翻译,并通过与YTHDF2的相互作用促进含m6A的mRNA的加速降解。
与YTHDF2/3的功能相反,包括IGF2BP1/2/3在内的胰岛素样生长因子2 mRNA结合蛋白(IGF2BP)家族保护P-body和应力颗粒中的m6A修饰的mRNA免受降解。通过与诸如RNA结合蛋白1(ELAVL1,也称为HuR),基质蛋白3(MATR3)和poly(A)结合蛋白胞质1(PABPC1)的ELAV相互作用,并促进mRNA的翻译。
有趣的是,来自哈佛大学干细胞研究所与波士顿儿童医院的Richard I. Gregory教授认为METTL3还可以充当细胞质中的阅读器,从而独立于其甲基转移酶活性来促进m6A修饰的mRNA进行翻译。由于m6A通常富集在终止密码子周围并且远离翻译起始位点,因此m6A在促进翻译起始中的作用是通过闭环模型实现的,其中通过真核翻译起始因子之间的相互作用介导mRNA环化(eIFs)位于mRNA的5’末端的亚基和METTL3或YTHDF1与终止密码子附近的m6A位点结合。总结下来就是,结合在mRNA终止密码子附近的METTL3蛋白可以通过与eIF3h结合,从而与5′端的帽子结构互作促使mRNA成环,进而促进mRNA的翻译。
也有另一种报道说,驻留在5’UTR中的m6A可通过将eIF3a募集到附近的翻译起始位点来促进不依赖帽的翻译。在翻译延伸期间,尽管就氨基酸编码而言,m6A修饰的密码子与未修饰的密码子相同,但对mRNA的m6A修饰却成为延迟tRNA调节的障碍,从而扰乱了翻译延伸动力学。
1.4 非编码RNA上的m6A修饰
lncRNA是一组内源性RNA分子,它们不翻译成蛋白质,但在调节基因表达方面具有特殊功能,可分为长度超过200 nt的lncRNA和长度小于200nt的小ncRNA。除了蛋白质编码的mRNA外,在ncRNA中还发现了m6A修饰,包括lncRNA、circRNA、miRNA、snRNA等,并被证明对其表达和功能很重要。
通过对polyA RNA进行富集后,许多课题组观察到了部分lncRNA中带有m6A修饰。由于没有编码能力,lncRNA通过与RNA结合蛋白的相互作用,与其他RNA种类的串扰或染色质重塑而参与基因表达的调控。
据报道,lncRNA的m6A修饰可能影响RNA-蛋白质相互作用。例如MALAT1是一个非常保守的明星lncRNA,其突变或上调一直与肿瘤发生和转移相关。MALAT1通常呈现m6A高甲基化修饰,并通过MeRIP-seq和miCLIP-seq检测到多个m6A修饰位点。这些m6A残基中的两个残基通过“m6A开关”机制阻止了RNA局部二级结构的形成,并增强了hnRNPC对MALAT1发夹中U5通道的识别和结。
m6A在lncRNA的RNA-RNA相互作用功能中也起作用,其中阻断干细胞多能性相关的let-7家族miRNA以确保小鼠胚胎发育需要对大型基因间编码RNA 1281(linc1281)进行内部m6A修饰干细胞身份(lincRNA1281上m6A修饰影响胚胎干细胞分化)。另一方面,lncRNA也可以与m6A调节剂相互作用以促进其功能。例如,FOXM1-AS是一种与FOXM1反义的lncRNA,可促进ALKBH5与FOXM1新生转录本的相互作用(m6A脱甲基酶ALKBH5维持致瘤性)。FOXM1-AS使得ALKBH5显著下调以调节FOXM1的m6A甲基化和表达。类似地,GAS5-AS是一种与GAS5互补的反义链lncRNA,可以通过与ALKBH5相互作用并调节GAS5的m6A修饰来增强GAS5的稳定性。我们推测似乎m6A调节功能可能是反义lncRNA的共同点。
miRNA是一类小型且高度丰富的非编码RNA,涉及基因沉默或转录后基因表达调控。从DNA转录而来的miRNA(pri-miRNA)初级转录物经过一系列裂解,形成发夹前体,miRNA前体(pre-miRNA)和成熟体miRNA。典型的m6A motif GGAC在pri-miRNA上丰度很高,但pre-miRNA和成熟的miRNA上并没有GGAC。然后pri-miRNA中的大多数可以被METTL3识别(m6A调控miRNA初级体识别加工)。具有m6A修饰的pri-miRNA可以被hnRNPA2B1识别,它可以与DGCR8相互作用并促进miRNA加工(m6A识别酶HNRNPA2B1介导RNA加工)。因此,通过METTL3敲低或过表达来改变m6A水平可能会导致miRNA成熟体整体表达水平发生大量改变。
circRNA是一种新型的ncRNA,与线性RNA不同,它通过反向剪接形成共价闭合的连续环。最近,发现m6A修饰在circRNA中也很普遍,并且通过与mRNA相同的机制进行读写。但是,circRNA中的m6A富集模式与mRNA不同,在其相应mRNA的翻译起始位点表现出富集。同时似乎YTHDF2识别m6A修饰的circRNA不会促进circRNA的降解,而是在调节mRNA稳定性和circRNA免疫中发挥作用。circRNA中的m6A修饰还可以通过募集YTHDF3和起始因子eIF4G2来驱动circRNA翻译蛋白。这两项工作均由中科院上海生化所的陈玲玲和马普计算所的杨力这对神仙眷侣领衔完成。
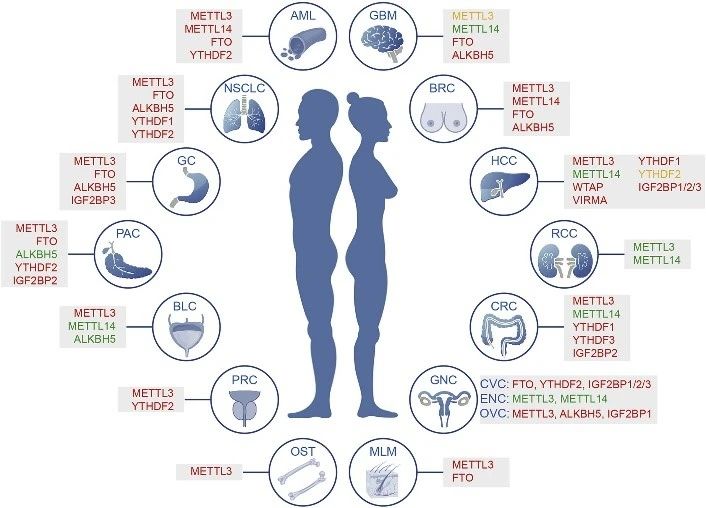
1.5 肿瘤中m6A修饰导致调节功能异常
图3. 肿瘤中m6A相关蛋白异常表达总览
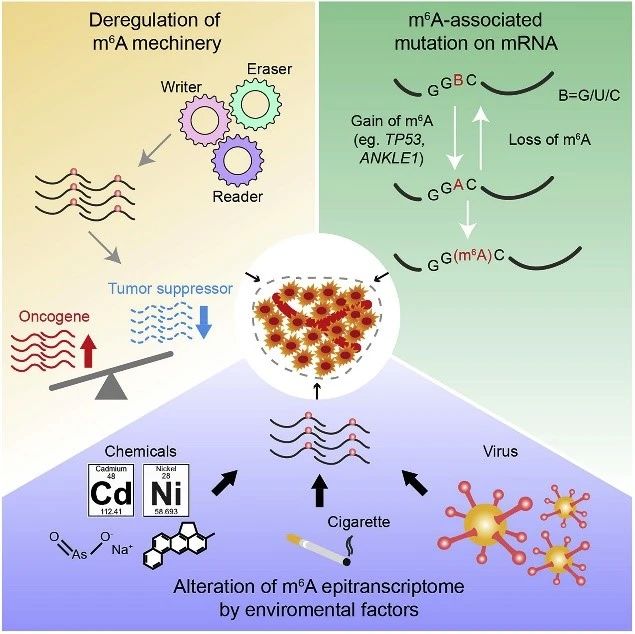
尽管m6A修饰不会改变碱基配对和编码功能,但它通过与各种阅读器蛋白质和相关复合物相互作用,广泛影响基因表达。因此,动态m6A修饰对于许多正常生物过程至关重要,包括胚胎干细胞和造血干细胞的自我更新和分化,组织发育,昼夜节律,热休克或DNA损伤反应以及性别决定。最近研究数据表明,m6A的整体修饰水平及其调节蛋白如Writers/Erasers/Readers的表达水平在各种类型的癌症中常常失调,并且对于癌症的发生、进展、转移、耐药、复发等至关重要。其他细胞内事件如引起m6A位点突变和细胞外刺激也可能也会影响细胞m6A修饰。
图4. 引起肿瘤中m6A修饰异常的原因
1.6 肿瘤中整体m6A水平异常
最近已经报道了某些类型的癌症中m6A整体丰度的异常降低或升高,这种失调可能与癌症的进展和临床结果有关。例如与正常对照组织相比,人胃癌组织中mRNA或总RNA的总体m6A水平(通过Dot Blot或比色ELISA样测定法检测到)显着增加。另一个研究小组发现,由于YTHDF2的减少,肝细胞癌HCC在mRNA上表现出整体m6A丰度的增加,并且mRNA表达增加。相反通过m6A Dot Blot以及免疫组化检测后发现,在人膀胱癌组织中,特别是在更晚期的膀胱癌中,总体m6A丰度显着降低。作者还表明,降低的m6A丰度与膀胱癌患者的预后不良有关。另外已经表明,m6A与药物反应有关,并且可能是白血病细胞中化学耐药性的表观遗传驱动力,其中通过酪氨酸激酶抑制剂(TKI)处理,m6A出现低甲基化响应且FTO表达量增加,以获得TKI的耐受性和增长优势。
1.7 m6A甲基化转移酶(Writers)在肿瘤的失控
METTL3在20多年前被首次鉴定为m6A甲基转移酶,后来发现在人体组织中广泛表达。然而,直到2017年METTL3作为m6A甲基转移酶的作用才首次出现癌症相关研究中。
据报道METTL3在AML细胞中起着重要的致癌基因的作用,它可以被CAATT-box结合蛋白CEBPZ募集到染色质上,从而在相关的mRNA转录本如SP1和SP2上诱导m6A水平上升。此外METTL3在AML中高度表达,还可以通过以m6A依赖性的方式促进包括MYC、BCL2和PTEN在内的靶mRNA的翻译,在AML细胞存活和白血病进展中发挥关键作用。
从那时起,已经报道了METTL3的过表达和促癌功能在许多其他类型的癌症,包括肝细胞癌、肝母细胞瘤、胃癌、结直肠癌CRC、非小细胞肺癌NSCLC和膀胱癌BLC。
METTL3通过依赖YTHDF2的机制抑制SOCS2表达来促进HCC生长并促进HCC进程(METTL3上调肝癌中m6A水平引起YTHDF2介导SOCS2降解),并且还参与了HCC细胞的上皮-间质转化(EMT)的调节通过YTHDF1介导的Snail mRNA翻译促进。两项研究均提示METTL3上调是肝癌患者的不良预后因素。
在胃癌中,METTL3水平升高也可以作为不良预后的独立预测因子。在CRC转移灶中发现更高的METTL3表达,并且与不良预后相关,SOX2被确定为可以被IGF2BP2稳定的下游靶标。另一小组也证实了METTL3表达与CRC转移的相关性,该研究报道了METTL3促进pri-miR-1246上m6A修饰从而产生更多的成熟miRNA。在BLC中也已经报道了METTL3的过表达及其不利的预后影响,其中它促进靶mRNA如AFF4/MYC/CDCP1/ITGA6,以及pri-miRNA如pri-miR221/222上的m6A修饰水平。
有趣的是,METTL3在NSCLC中的致癌功能很复杂,其中METTL3可以促使YAP mRNA发生m6A修饰并募集YTHDF1/3和eIF3b来促进YAP mRNA的翻译,或者可以与eIF3h相互作用来促进靶标的翻译。mRNA如BRD4与其酶活性无关。在卵巢癌(OVC)中也报告了METTL3的不依赖酶活性的致癌作用。
与METTL3相似,METTL14也包含MT-A70结构域(即甲基转移酶结构域MTD),并与METTL3形成异二聚体复合物。最近的蛋白晶体结构学研究表明,METTTL14的催化中心已退化,因此不参与催化反应。相反,为了稳定METTL3构象和底物RNA结合,需要METTL14来参与协助。作为MTC的重要组成部分,METTL14也已被证明过表达并在各种类型的癌症中发挥重要作用。
METTL14过表达并在AML的发生和发展中起着关键的致癌作用。敲低METTL14能够抑制白血病干细胞/起始细胞(LSCs/LICs)的自我更新并促进AML细胞的髓系分化,这个功能的实现主要是通过降低其目标mRNA MYB和MYC的m6A丰度,继而负面调节其mRNA稳定性和翻译。在正常的造血过程中,还发现Mettl14在鼠造血干细胞中高表达,并在造血过程中下调,特别是在成熟的髓样细胞中。敲除Mettl14可适度抑制小鼠造血干细胞的自我更新并促进骨髓分化。在乳腺癌细胞中,显示METTL14和ALKBH5通过控制关键EMT和与血管生成相关的转录本中的m6A水平来控制彼此的表达并发挥促癌作用。
WTAP在被确定为m6A甲基转移酶复合物的组成部分之前,在AML中被上调并作为癌基因发挥作用。最近,在肝癌中报道了WTAP与m6A相关的功能,其中WTAP通过huR-ETS1-p21 / p27上调并促进了肝癌的发展。这就显示出MTC的另一种成分——VIRMA在HCC中的表达高于正常肝组织,并通过以m6A依赖性方式调节ID2 mRNA或GATA3 pre-mRNA来增强HCC的迁移和侵袭。
相比之下,有人认为METTL3在肾细胞癌和子宫内膜癌中具有抑癌作用。与相邻的非肿瘤相比,METTL3在肿瘤样品中的表达较低样品,导致AKT信号通路的激活和这种肿瘤细胞的增殖和致瘤性增加。不同人群报道了METTL3在胶质母细胞瘤(GBM)中的争议性作用,这可能是由于原始样品的来源不同引起的使用,因此反映了GBM的异质性问题。
类似地,在几种类型的癌症中,METTL14也显示出下调并显示出肿瘤抑制作用。人类子宫内膜癌的METTL14中存在一个热点R298P突变,导致患者子宫内膜肿瘤样品中的mRNA上m6A修饰减少,并可能促进子宫内膜癌细胞的致瘤性。肝癌中METTL14和m6A的水平降低,这说明肝癌的高转移能力。在BLC中还观察到METTL14的下调和总体m6A丰度的降低呈现正相关,并且与BLC患者的预后差和疾病阶段更晚期有关。通过经由m6A依赖性机制的转录后抑制NOTCH1表达,METTL14抑制了膀胱肿瘤引发的细胞自我更新和膀胱肿瘤发生。此外,GBM中还报道了METTL14的下调和肿瘤抑制作用。
1.8 m6A去甲基化酶(Erasers)在肿瘤的失控
尽管早在2008年何川课题组的贾桂芳博士发现,FTO已经显示出对RNA和DNA上其他类型修饰的催化活性。但是FTO m6A去甲基化酶功能正式的敲实发生在2011年,这项工作主要由贾桂芳博士和付晔博士完成(m6A去甲基化酶FTO的难产之路 | m6A八卦故事)。
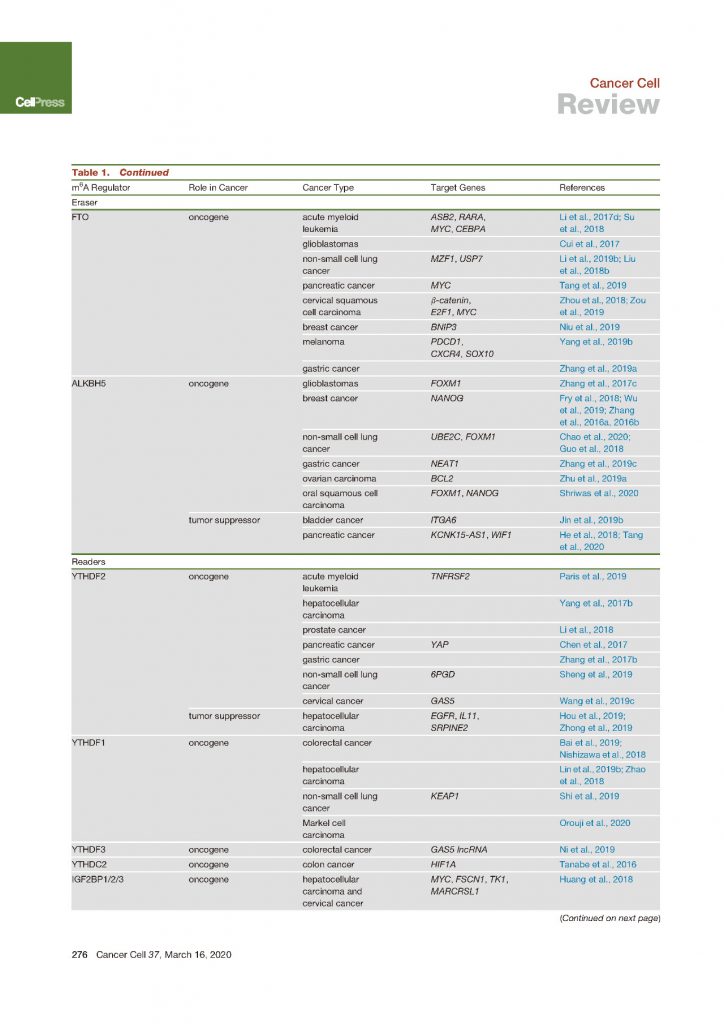
接下来FTO在癌症中作为m6A去甲基酶首次在AML中报道,发现FTO被高度表达(m6A去甲基化酶FTO对急性骨髓白血病有致癌作用)。事实证明,FTO可以作为致癌基因来促进白血病发生并抑制全反式维甲酸(ATRA)介导的白血病细胞分化,方法是通过减少这些mRNA转录物上的m6A丰度来促进ASB2和RARA的mRNA稳定性。
进一步的研究表明FTO是R-2-羟基戊二酸(R-2HG)的直接靶标,R-2-羟基戊二酸是突变型异柠檬酸脱氢酶1/2(IDH1 / 2)酶产生的高水平代谢物。R-2HG可抑制FTO的活性,导致m6A丰度增加,MYC和CEBPA mRNA的稳定性降低,继而引起白血病细胞的生长抑制,细胞周期停滞和凋亡。结果,R-2HG表现出固有的抗白血病活性。其他研究还报道了在实体肿瘤中FTO的致癌功能,例如GBM、乳腺癌、和黑素瘤MLM。
FTO抑制剂MA2对FTO的抑制表现出METTL3过表达抑制GBM干细胞(GSC)生长和自我更新以及抑制异种移植小鼠肿瘤进展的作用。在乳腺癌中,FTO通过对BNIP3 mRNA的负调控来促进癌细胞的增殖和转移,而高水平的FTO与不良的预后相关。最近的一些研究表明,黑色素瘤的自噬和NF-κB途径可通过代谢应激诱导FTO。结果,与正常皮肤组织相比,人MLM中的FTO表达增加,并且高水平的FTO促进了裸鼠中MLM细胞的生长。
FTO别名ALKBH9,与FTO同属于属于Fe(II)/αKG双加氧酶的AlkB亚家族的ALKBH5是第二个鉴定出的RNA m6A脱甲基酶。ALKBH5被鉴定为m6A去甲基化酶后不久,一项研究表明ALKBH5参与了低氧肿瘤微环境中乳腺癌干细胞(BCSC)的富集。低氧条件下乳腺癌细胞中低氧诱导因子依赖的方式可以诱导ALKBH5的表达,导致NANOG mRNA中m6A丰度的降低和多能因子蛋白水平的升高,从而使BCSCs富集。
另一项研究表明ALKBH5在GSC中高表达,其高表达水平与GBM患者的临床预后不良有关。使用培养的人GSC和异种移植模型进行的体外和体内试验表明,ALKBH5促进GSC增殖和自我更新。有趣的是,以FOXM1反义方向转录的染色质结合型lncRNA FOXM1-AS促进了ALKBH5募集至其新生的目标转录本FOXM1。ALKBH5使FOXM1 pre-mRNA脱甲基促进了HuR结合,并提高了FOXM1 pre-mRNA的稳定性并增强了FOXM1蛋白的表达,这对于维持GSC致瘤性至关重要(m6A脱甲基酶ALKBH5维持致瘤性)。
一项研究表明m6A RNA修饰在膀胱癌中的功能,发现与METTL3相比,ALKBH5通过依赖于m6A的转录后调控抑制了膀胱癌细胞的生长和进程,从而抑制了ITGA6的表达。在胰腺导管腺癌(PDAC)中,ALKBH5还显示出通过减少WIF-1 RNA上的m6A修饰并介导Wnt信号,以及ALKBH5致敏的PDAC细胞对化疗的过度表达而表现出的肿瘤抑制作用。
1.9 m6A阅读蛋白(Readers)在肿瘤的失控
m6A阅读器蛋白通过控制修饰的RNA的命运来介导m6A修饰的作用。因此,阅读器蛋白的失调可能导致对修饰的RNA的错误解释以及随后的RNA代谢紊乱。作为第一个报道的m6A阅读器,YTHDF2已在各种癌症类型中进行了广泛研究,并显示在大多数癌症类型中均具有致癌作用。
在前列腺癌中,与邻近的正常组织相比,YTHDF2在癌组织中上调。实验表明miR-493-3p对YTHDF2有负调节作用,通过对miR-493-3p的抑制可以消除YTHDF2敲低对前列腺癌细胞增殖和迁移的抑制作用。跟AML中METTL3和METTL14的上调相一致,与健康对照相比在AML样品中YTHDF2在AML样品中表达更高,在LSC活性的AML细胞中YTHDF2的表达高于无LCS活性的细胞。此外,YTHDF2通过降低对LSC功能重要的mRNA的半衰期,对于AML的启动和转移至关重要。
然而YTHDF2在HCC中同时具有致癌作用和抑癌作用。通过使用免疫组化检测临床HCC组织中YTHDF2的表达后发现,YTHDF2的表达与HCC的恶性程度有关,并受到miR-145的负调控(miR-145是一种在HCC患者中下调的miRNA)。相比之下,低氧环境下的HCC中YTHDF2的表达受到抑制,YTHDF2的强制表达通过直接结合EGFR 3’UTR以促进EGFR mRNA的降解而在体内外抑制HCC细胞的增殖和生长。
通过对TCGA数据库的挖掘,在所有YTH家族蛋白中,YTHDF1是唯一在CRC样品中表达高于正常部分的蛋白。YTHDF1高表达的CRC患者总体生存期较差,提示YTHDF1是预后因素。促癌MYC蛋白的DNA拷贝数扩增或潜在的转录调控可能是CRC中YTHDF1高表达的原因之一。同样,YTHDF1在肝癌中高表达,并在肝癌患者中充当不良预后因素。
最近的一项研究确定YTHDF1是在低氧适应中快速进化的基因之一。与平原动物相比,长期处于高原缺氧状态下的藏族哺乳动物中的YTHDF1表达量有所降低。此外,YTHDF1在NSCLC中表达量有所上升,对NSCLC细胞增殖、异种移植肿瘤形成和肺癌进展至关重要。令人惊讶的是,这项研究还发现YTHDF1的低表达使癌细胞对顺铂治疗具有耐药性,并导致更差的临床结果。这项研究强调了YTHDF1在低氧适应和NSCLC发病机理中的重要作用(Nat Com用户m6A文章:YTHDF1影响NSCLC进展)。
此外癌症中YTH家族表达失调的其他研究近几年也有所表达。YTHDC2表达与结肠肿瘤分期,包括转移呈正相关且 YTHDC2的高表达通过促进HIF-1α的翻译起始而促进了结肠肿瘤的转移。此外来自中山大学孙逸仙纪念医院李建明团队的倪雯博士发现,在CRC中lncRNA GAS5与YAP-YTHDF3形成负反馈调控网络。与YAP相互作用的lncRNA GAS5可以直接与YAP结合,以促进其磷酸化和泛素介导的降解,从而导致YAPDF3的YAP介导的转录减弱,以及GAS5从YTHDF3介导的m6A依赖性衰变中释放出来。由于YTHDF3在CRC组织中的表达水平明显高于对应的正常组织,因此这种负反馈环维持了YTHDF3的表达并确立了YTHDF3在CRC进展中的关键作用(m6A lncRNA GAS5抑制结直肠癌发生且受到YTHDF3负调控)。
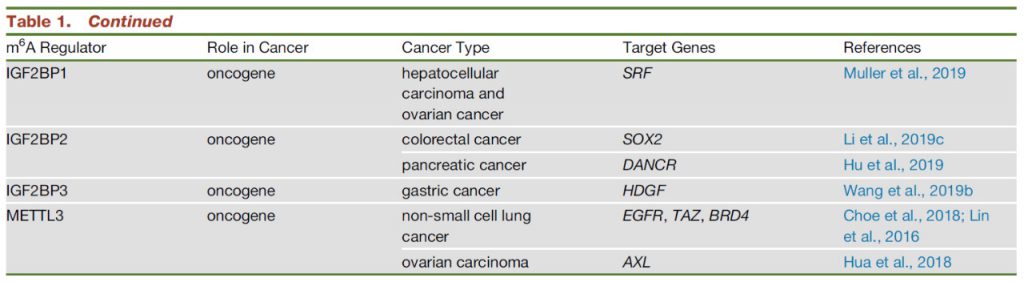
尽管最近才将IGF2BP1/2/3蛋白鉴定为m6A阅读蛋白,但先前已在各种癌症中观察到了它们的表达增加。其中,IGF2BP1和IGF2BP3是癌胚蛋白,由肿瘤以及胎儿组织产生,但在成人组织中被下调。所有IGF2BP蛋白均通过与目标转录物(包括MYC)上的m6A位点结合来稳定这些mRNA并促进其翻译,从而促进HCC细胞和宫颈癌细胞的细胞增殖,集落形成,迁移和侵袭(RNA m6A阅读蛋白IGF2BP增强mRNA稳定性&促进翻译)。
最近研究表明,IGF2BP1通过削弱miRNA靶向的SRF mRNA翻译水平减弱来以m6A依赖性方式促进SRF的表达,从而导致增强的SRF依赖性转录活性以及肿瘤细胞的生长和侵袭。与配对的正常胃粘膜相比,胃癌中IGF2BP3表达显着增加,并且IGF2BP3与HDGF mRNA中m6A位点的结合增强了其稳定性,从而导致HDGF的表达和分泌增加,进而导致胃癌的生长和肝转移。
此外,IGF2BP也已显示与ncRNA结合如lncRNA等。据报道,在胰腺癌患者中被上调并与不良预后相关的IGF2BP2通过与m6A修饰的DANCR结合来稳定lncRNA DANCR IGF2BP是否通过m6A依赖性方式识别癌症中的其他ncRNA,其功能性后果还有待研究。
1.10 肿瘤中m6A位点突变相关研究
许多研究表明m6A相关蛋白如Writers/Erasers/Readers调节异常,会导致关键基因的m6A修饰也出现异常,并在转录后异常调节这些癌症相关基因的表达。因此有理由推测,此类转录本的m6A位点中的突变可能会干扰m6A修饰,从而在癌症中起作用。
TP53的pre-mRNA上273位密码子中的G>A突变(导致R273H突变)以m6A依赖性方式赋予结肠癌细胞耐药性。密码子273中的转运腺苷(transited adenosine)被METTL3催化甲基化并促进优先mRNA剪接和R273H突变体p53蛋白的产生,从而导致结肠癌细胞获得了多药耐药性。
最近一项队列研究发现了一种错义变体,即位于ANKLE1外显子上的rs8100241变体,其CRC发生G> A改变(导致Ala>Thr改变),并表明它与降低患CRC风险相关。从机理上讲,与rs8100241 [G]等位基因相比,rs8100241 [A]等位基因可以被m6A甲基转移酶催化产生m6A修饰,并继而被YTHDC1识别,从而增加了ANKLE1的蛋白表达。ANKLE1是一种潜在的肿瘤抑制因子,可通过维持基因组稳定性来抑制细胞增殖。
除了由于癌症突变而重新获得m6A修饰的A位点之外,还可能存在导致m6A修饰缺失的突变,并有助于癌症的发展和对药物反应发生变化。中山大学任间课题组与屈良鹄课题组,开发了一些在线工具可将m6A位点信息和SNP信息整合在一起,以促进癌症中功能性m6A位点突变的研究。同样重要的是,部分课题组可以借助高分辨率的m6A测序方法来获得每种癌症类型和相应正常组织中m6A甲基化组的更准确和全面的视图。
1.11 外部条件刺激后转录水平整体m6A修饰水平变化
据NIH/NCI的报告估计,在美国所有癌症病人中,大约三分之二的原因是因为暴露于多种外界环境因素中如香烟、酒精、辐射、环境化学物质和病毒等。除了细胞内事件如m6A甲基化酶失调和m6A相关碱基发生突变外,外部环境刺激可调节m6A修饰并有助于癌症的发展。
化学致癌物可导致癌症易感基因发生基因突变和/或诱导表观遗传变化以促进致癌转化。慢性用亚砷酸钠处理的人支气管上皮细胞后,发现mRNA上的m6A修饰显着增加,并转化为恶性表型,而METTL3沉默可使其逆转并减缓恶性程度。
在另一项研究中,由化学致癌物如镉Cd、3-甲基胆红素和镍Ni转化的不同类型的人类上皮细胞,显示出m6A整体丰度出现动态变化。后续的分子机制研究表明,m6A修饰水平异常的致癌基因CDCP1是化学诱导后肿瘤出现恶性转化的关键靶靶基因,并建议METTL3-m6A-CDCP1调控通路可能是治疗化学诱导的癌症的潜在治疗靶标。
中山大学肿瘤防治中心林东昕/郑健课题组中,张嘉良博士作为第一作者完成这项工作。研究表明m6A修饰参与香烟烟雾诱导的癌症发展(吸烟诱导m6A上升促进miR-25-3P加工影响胰腺癌进展)。人胰管上皮细胞或胰腺癌细胞暴露于香烟烟雾冷凝物中会导致METTL3基因启动子中的DNA甲基化水平不足,并募集NFIC转录因子以诱导METTL3表达。高水平的METTL3显着催化pri-miR-25中m6A修饰水平上升,并导致成熟miR-25-3p的表达水平升高,从而抑制PHLPP2 mRNA表达并激活致癌性AKT-p70S6K信号通路,从而促进胰腺导管腺癌PDAC进展和恶化。
在病毒方面,EBV潜伏蛋白EBNA3C可以通过直接与METTL14相互作用在宿主细胞中激活METTL14的转录并提高METTL14的蛋白稳定性。METTL14在EBV潜伏感染细胞中表达的增加通过m6A依赖性机制重新编程了转录组并上调了必需的EBV潜伏抗原,包括EBNA3C,因此有助于EBV介导的肿瘤发生。
2、RNA上m6A修饰对于肿瘤治疗的影响
2.1 靶向m6A甲基化酶作为癌症疗法的有效手段
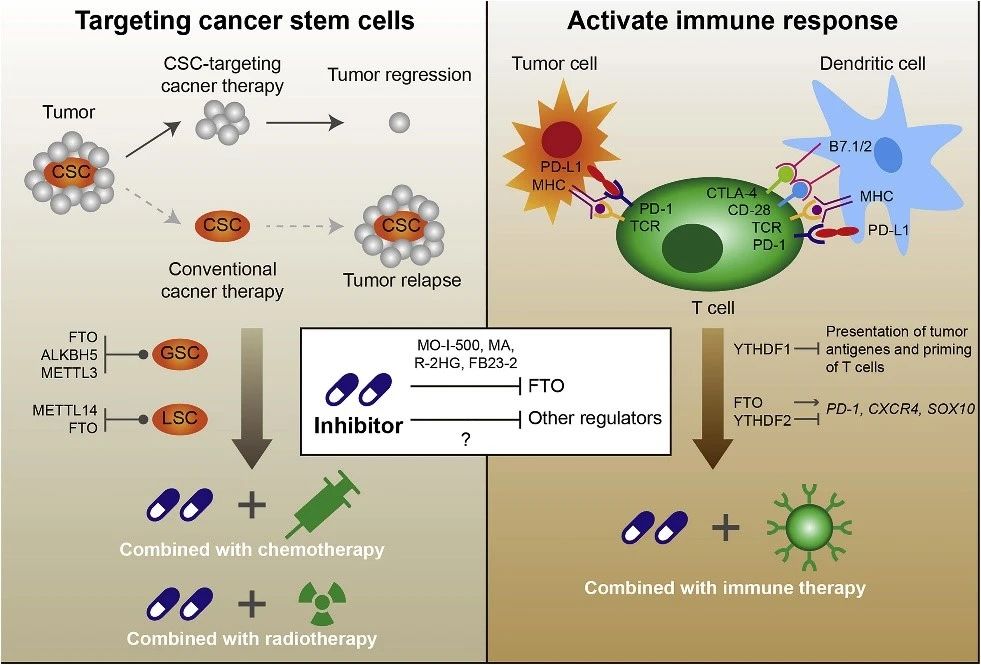
图5. m6A修饰在肿瘤治疗中的意义。考虑到GSC中FTO、ALKBH5和METTL3的作用以及LSCs中METTL14和FTO的作用,m6A甲基化酶的抑制剂具有与化疗+放疗联合使用以清除肿瘤干细胞的潜力。此外m6A甲基化酶也在免疫系统中起作用,因此当与免疫疗法结合时,是增强抗肿瘤免疫力的潜在靶标。
去甲基化酶FTO一直是开发针对m6A甲基化酶的抑制剂以治疗癌症的最有吸引力的靶蛋白之一。开发出MO-I-500以选择性抑制FTO的m6A去甲基酶活性,并显示出可以抑制三阴性炎症性乳腺癌细胞系的存活和/或集落形成。
甲氯芬那酸(MA)是一种非甾体类抗炎药,已被证明比ALKBH5更具有特异性抑制FTO的作用,并且进一步被证明具有抑制GBM细胞生长和存活的作用。
R-2HG是IDH1/2突变体的主要代谢产物,被发现是FTO抑制剂,可直接与FTO结合并抑制其m6A去甲基酶活性,从而抑制白血病细胞的生长/存活以及白血病的进展。而来自上海中科院药物所杨财广课题组开发出了一种更有效的FTO抑制剂FB23-2,该抑制剂显着抑制了异种移植小鼠的AML进展。
当癌细胞对包括化疗、放疗和靶向疗法在内的治疗出现抵抗时,就会发生耐药,并导致治疗失败和癌症复发。耐药的潜在机制各不相同,包括癌细胞的遗传和/或表观遗传变化,癌细胞所处的微环境以及少数自我更新,耐药的癌症干细胞的存在。m6A甲基化酶的失调并且在各型的癌症中起重要作用表明,m6A修饰可能与耐药性有关。
FTO通过降低β-cateninm RNA中的m6A丰度来增强子宫颈鳞状细胞癌对放疗的抵抗力,而BRCA突变的上皮性卵巢癌中FZD10 mRNA的m6A修饰明显增强。FTO和ALKBH5的下调可能导致PARPi敏感性降低。另外,具有FTO上调和m6A亚甲基化的白血病细胞由于具有m6A的增殖/存活相关转录本的mRNA稳定性增强,因此具有提高的TKI耐受性和生长优势。
以上数据表明,m6A修饰可以用作个性化癌症治疗的预测标记,并通过调节m6A相关途径阐明克服癌症治疗抗性的途径。令人鼓舞的是,已经出现了不少概念性的验证研究来支持这种观点。在AML中,METTL14或FTO的敲低可使白血病细胞对分化诱导剂ATRA敏感。通过抑制FTO信号传导,R-2HG治疗可使AML细胞对多种一线治疗剂敏感,例如ATRA、5-氮胞苷(5-Aza)、地西他滨(DAC)、柔红霉素(DNR)和阿糖胞苷(Ara-C),并使GBM细胞对替莫唑胺(TMZ)敏感。
此外,在GSC和GBM肿瘤中出现高表达的METTL3通常预后较差,在METTL3被沉默后GSC对γ辐射的敏感性增强。同样,METTL3敲低后的胰腺癌细胞对抗癌药物或放疗化疗更敏感。
2.2 m6A修饰与免疫治疗
免疫系统是一种宿主防御系统,可防止宿主出现感染和疾病发生。近年来,一些研究表明RNA上的m6A修饰参与免疫系统的发展和免疫应答的诱导。当淋巴细胞稳态发生剧烈变化时,尤其是当Mettl3被敲除时,T细胞被阻止稳态扩增并保持为Naive状态。从机制上讲,Mettl3敲除导致m6A水平降低,Socs1/Socs3/Cish的mRNA稳定性和蛋白水平提高,从而对CD4+ T细胞中的IL-7信号传导产生负调控。
曹雪涛院士课题组揭示了m6A在树突状细胞激活中的作用,其中Mettl3介导的CD40/CD80/TLR4信号转接基因Tirap转录本上的m6A修饰增强了树突状细胞中的翻译,从而增强了TLR4 /NF-κB信号转导诱导的细胞因子的产生和刺激T细胞活化。
最近两项独立研究报道了m6A修饰在控制对dsDNA或病毒的先天免疫应答中的作用。Rubio等发现与ALKBH5敲除相反的是,METTL14敲除减少了宿主细胞中人巨细胞病毒(HCMV)的繁殖,并刺激了dsDNA或HCMV诱导的干扰素β1(IFNB1)mRNA的产生和稳定。同样Winkler等报道,病毒感染后METTL3或YTHDF2的敲除以m6A依赖性方式稳定了IFNB1,从而导致病毒在宿主细胞中的传播随后受到抑制。
有趣的是,上海中科院生化所陈玲玲课题组及马普计算所的杨力课题组发现,内源性人circRNA被m6A修饰,并可以被YTHDF2识别,YTHDF2可以阻断并影响m6A修饰的circRNA,对于抑制先天免疫来说至关重要,而外源性的circRNA未被m6A修饰并且可以诱导抗原特异性T细胞活化、抗体产生和抗肿瘤免疫力。
免疫疗法是一种新的癌症疗法,可以刺激和改善免疫系统对抗癌细胞的天然天生能力。最近有研究发现YTHDF1通过以m6A依赖性方式调节溶酶体蛋白酶的表达来控制抗肿瘤免疫力并改善免疫疗法(m6A甲基化和YTHDF1在树突状细胞中控制抗肿瘤免疫)。YTHDF1可以识别已带有m6A修饰的编码溶酶体蛋白酶相关mRNA,以增加其在树突状细胞中的翻译能力从而产生更多的蛋白,而Ythdf1的缺失增强了体内肿瘤抗原的交叉表达和CD8+ T细胞的交叉呈递。此外,Ythdf1缺失增强了PD-L1检查点抑制剂的治疗效果。
在黑色素瘤中,FTO水平的升高通过减少PD-1(PDCD1)、CXCR4和SOX10中的m6A水平,并防止其由YTHDF2介导的RNA降解来促进肿瘤生长。敲除黑色素瘤细胞中的FTO可在体外使肿瘤细胞对干扰素γ(IFNγ)敏感,并在小鼠中促进黑色素瘤对抗PD-1抗体的反应。
以上这些研究中的数据共同表明,m6A甲基化酶的调节可与抗PD-1 / PD-L1阻断剂结合使用,以改善抗癌免疫疗法。
3、总结与展望
在过去的几年中,人们致力于研究m6A修饰在癌症中的作用,从而产生了大量的实验数据,并增加了对m6A修饰的作用及其相关机制在各种类型癌症中的认识。
现在清楚的是,在各种类型的癌症中,总体m6A水平和m6A甲基化酶Writers/Erasers/Readers的表达失调,其可能与癌症患者的耐药性和预后有关。越来越多的证据表明,m6A甲基化酶可通过调节癌症在mRNA上的碱基修饰水平,从而影响其在各种类型的癌症中发挥重要作用(通常是促癌作用)。
值得注意的是,在某些类型的癌症如AML、乳腺癌、肺癌和胃癌中,m6A的Writers和Erasers均异常表达,并起重要的致癌作用。尽管尚未完全理解其潜在的分子机制,但这种现象表明,异常表达的Writers和Erasers对转录组的调节异常可能会导致类似的表型。
由于m6A的Writers和Erasers在此类癌症中均过表达,因此RNA上整体的m6A丰度在临床上的意义可能并不十分有用。取而代之的是,某些特定转录本或基因上的m6A修饰水平,更有可能成为某种Biomarker被用于癌症诊断和预后。
但是,目前可用的转录组范围的m6A-seq方法通常需要很高的total RNA起始量(通常需要>20μg),因此很难对大量患者进行m6A-seq检测。因此,迫切需要大大改进当前的m6A-seq技术,使得更少的RNA起始量更高的分辨率成为可能。
借助改进的m6A-seq技术,我们可以使用患者身上珍贵的原发灶样本,甚至有限的原发性癌症干细胞或肿瘤细胞进行m6A修饰水平分析。并且可以将某些特定转录本或转录本基因座的m6A修饰图谱,作为癌症早诊、分类、结果预测和风险分级的生物标记。
除癌细胞外,从癌症患者血浆中收集的循环RNA也可用于m6A-seq分析。并且特定的m6A标记可用作临床应用中的生物标记。
迄今为止,更多的研究都集中在鉴定癌症中m6A修饰的mRNA靶标上,而对ncRNAs上m6A修饰的研究则较少。因此ncRNA上m6A修饰代表了未来的方向之一。研究m6A修饰如何影响ncRNA的产生、细胞位置、、功能以及这些过程与癌症的关系将极大地拓宽我们对m6A修饰的ncRNA在细胞中未知功能的了解。
最近,何川课题组与韩大力课题组再次发力,在与染色体相关的调节性RNA(carRNA)上发现了m6A修饰,包括与启动子相关的RNA、增强子RNA和重复RNA等,并被证明可调节染色质状态和转录。这些carRNA是否在癌症中起作用仍然是一个有趣的话题,值得进一步研究。
鉴于m6A的Writers/Erasers/Readers在各种类型癌症中功能的重要性,靶向那些已经失控的m6A甲基化酶代表了一种极具吸引力有的癌症治疗策略。确实,一些先驱性概念验证研究已经表明,通过小分子抑制剂靶向失调的m6A甲基化酶具有治疗癌症的潜力。一些小型制药或生物技术公司如STORM Therapeutics、Accent Therapeutics(由何川和Howard Chang张元豪共同创立)、Gotham Therapeutics和Genovel Biotech Corp等公司已开始开发,针对m6A甲基化酶如METTL3、METTL14和FTO等高效且选择性强的小分子抑制剂。
除了直接靶向m6A甲基化酶的小分子化合物外,还可以开发基于PROTAC(针对嵌合体的蛋白水解作用)的抑制剂来选择性降解失调的m6A甲基化酶以用于癌症治疗。
此外,由于m6A修饰在介导癌症对化疗、放疗和免疫疗法的反应中也起着重要作用,因此针对m6A甲基化酶的靶向治疗也可以与化疗、放疗和免疫疗法一起在临床中得到充分的应用,以在不久的将来改善当前仍然问题重重的癌症治疗。
另外,诸如在CRISPR等基因编辑技术上,还可以开发基于转录组层面的编辑方法以恢复或去除在癌症中突变或失调的mRNA上的m6A修饰位点,并且这种编辑将来也可能在临床上用于癌症治疗。目前中山大学药学院王红胜教授正在紧张开发相应技术,这项研究已经提前发表在了预印本bioRvix上,不久后可能会刊登在Science Advanced杂志上。
总体而言,癌症中m6A修饰的研究是癌症研究中的一个新领域,它不仅揭示了癌症中表观遗传调控的新层,从而为肿瘤发生、免疫应答和耐药性的潜在分子机制提供了新颖见解,并随之开发有效的新型疗法。尤其是对目前产生抗药性的癌症治疗方案上,单一治疗或与其他疗法联合使用,有效抑制靶向失调的m6A甲基化酶(或通过靶向转录层面编辑靶向靶向突变或功能失调的m6A位点)可能具有治疗各种类型癌症的强大治疗潜力。






来第一个抢占沙发评论吧!