转自: CNS说(微信公众号)
在全世界范围内,肝脏肿瘤占男性肿瘤相关死亡率的第二位,并且在发展中国家更加显著。肝细胞性肝癌(Hepatocellularcarcinoma,HCC)是肝脏最主要的恶性肿瘤。
由于缺乏有效的HCC早期诊断和高危人群临床前筛查的方法,只有三分之一的HCC病人在临床确诊时适合外科手术。早期肝癌患者手术后五年生存率较高,而中晚期则预后不佳。因此,寻找有效的早期HCC标志物、对肝癌早期发生的机理进行深入研究对于提高病人的预后和生存特别重要。
本研究通过cirRNA、mRNA和miRNA表达谱芯片筛选出一个在肝癌早期特异性高表达的cirRNA:Circ-CDYL,并构建了由Circ-CDYL驱动的ceRNA网络。Circ-CDYL、HDGF和HIF1AN三分子联用在诊断早期肝癌上呈现出了较高的灵敏度和特异性,为肝癌早诊提供了新线索。
王红阳院士团队肝癌早诊新进展:CircRNA-CDYL驱动的ceRNA调控网络
作者 | 碧海仙
文编 | 高野
美编 | 穿马甲的啄木鸟
海军军医大学东方肝胆外科医院、国家肝癌科学中心李亮副研究员课题组在王红阳院士的带领下,长期从事肝癌早期诊断和早期机制研究工作。近期,该课题组利用表达谱芯片对极早期(BCLC 0期)肝癌组织和邻近癌旁组织的circRNA(环状RNA),mRNA和microRNA进行了全面的差异表达分析。
研究发现,CircRNA-CDYL(以下称Circ-CDYL)在肝癌早期特异性表达升高,并显著促进了EPCAM阳性的肝癌起始细胞特性。Circ-CDYL通过吸附miR-892a和miR-328-3p,分别调节肝癌来源生长因子HDGF和缺氧诱导因子天冬酰胺羟化酶HIF1AN的表达,形成了以Circ-CDYL为核心的竞争性内源性RNA(ceRNA)调控网络。
进一步的机制研究发现,HDGF下游的PI3K-AKT-mTORC1/β-catenin信号通路和HIF1AN下游的NOTCH2信号通路被Circ-CDYL调节,导致癌蛋白MYC和SURVIVIN表达升高,最终促进了早期肝癌的发生、发展。干扰Circ-CDYL表达,同时联合使用靶向PI3K和HIF1AN分子的抑制剂Wortmannin和NOD,可高效抑制肝癌细胞的生长。
临床样本分析发现,Circ-CDYL或Circ-CDYL联合HDGF和HIF1AN,均可作为区分早期肝癌的独立标志物。该研究日前发表在肝脏病学领域权威期刊Hepatology(IF:14.079)上。

研究思路和研究结果
研究者首先通过生物芯片分析了极早期肝癌组织和邻近正常组织的circRNA,mRNA 和miRNA表达谱,发现有92个circRNA表达上调,85个circRNA表达下调;9470个mRNA表达上调,10765个mRNA表达下调;310个miRNA表达上调,142个miRNA表达下调。
为了进一步研究circRNA,miRNA和mRNA之间的相互作用,作者进行了RNA互作网络分析,并基于竞争性内源性RNA(ceRNA)调控特点,依据三个标准进行了筛选:
1)候选circRNA和mRNA具有共同的miRNA作用元件(MRE);
2)候选circRNA和mRNA在肝癌组织和正常组织中的变化趋势一致;
3)排除由差异表达miRNA所介导的互作网络。
筛选得到了126个共同上调的circRNA-mRNA对和74个共同下调的circRNA-mRNA对。作者最终挑选了在早期肝癌组织中上调最显著的Circ-CDYL进行下一步研究。Circ-CDYL 通过吸附miR-892a和miR-328-3p,分别调控肝癌来源生长因子HDGF和缺氧诱导因子天冬酰胺羟化酶HIF1AN的表达。
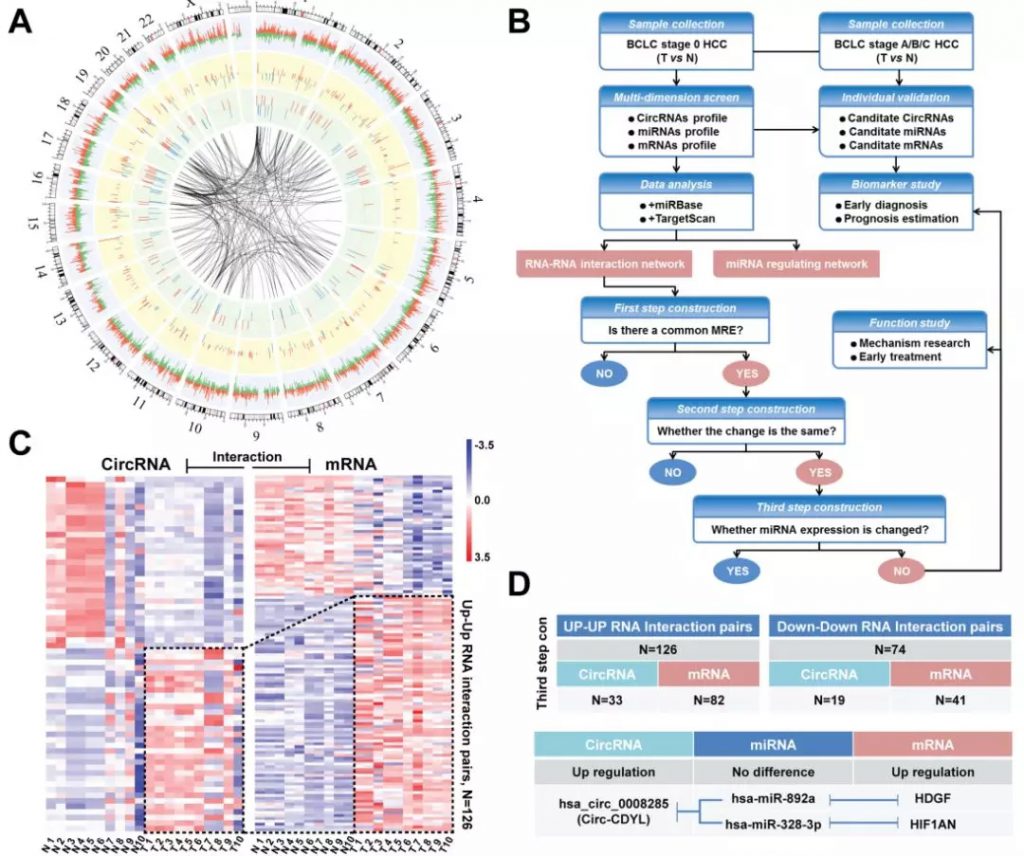
随后研究者使用qRT-PCR技术对Circ-CDYL、HDGF和HIF1AN在肝癌早期组织(0和A期)和肝癌晚期组织(B和C期)进行了验证,结果与芯片结果一致。一代测序结果证实了Circ-CDYL来源于基因CDYL的2号外显子,核质分离实验则表明Circ-CDYL在细胞核和细胞浆中均有表达,但主要位于细胞浆中,提示Circ-CDYL可能作为ceRNA发挥功能。
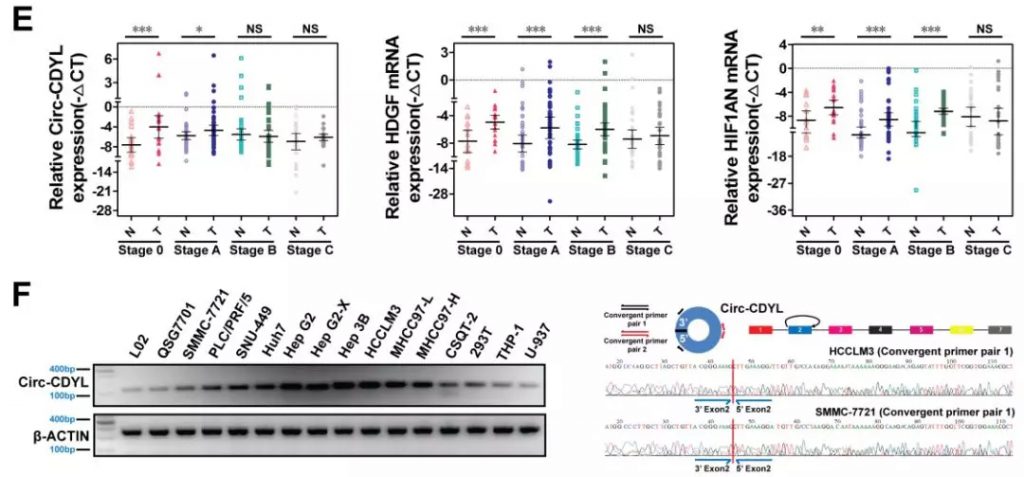
接下来研究者对Circ-CDYL的生理功能进行了探索,体外敲低和过表达实验表明,Circ-CDYL可促进癌症细胞增殖(CCK8细胞增殖实验),提升肝癌起始细胞(T-ICs)和EPCAM阳性肝肿瘤起始细胞(T-ICs)的比例(FACS),促进肝癌细胞自我更新(肿瘤成球实验),增强癌细胞对化疗药的耐受性(FACS检测细胞凋亡)和HCC细胞在小鼠体内的成瘤能力(小鼠肿瘤移植模型)。
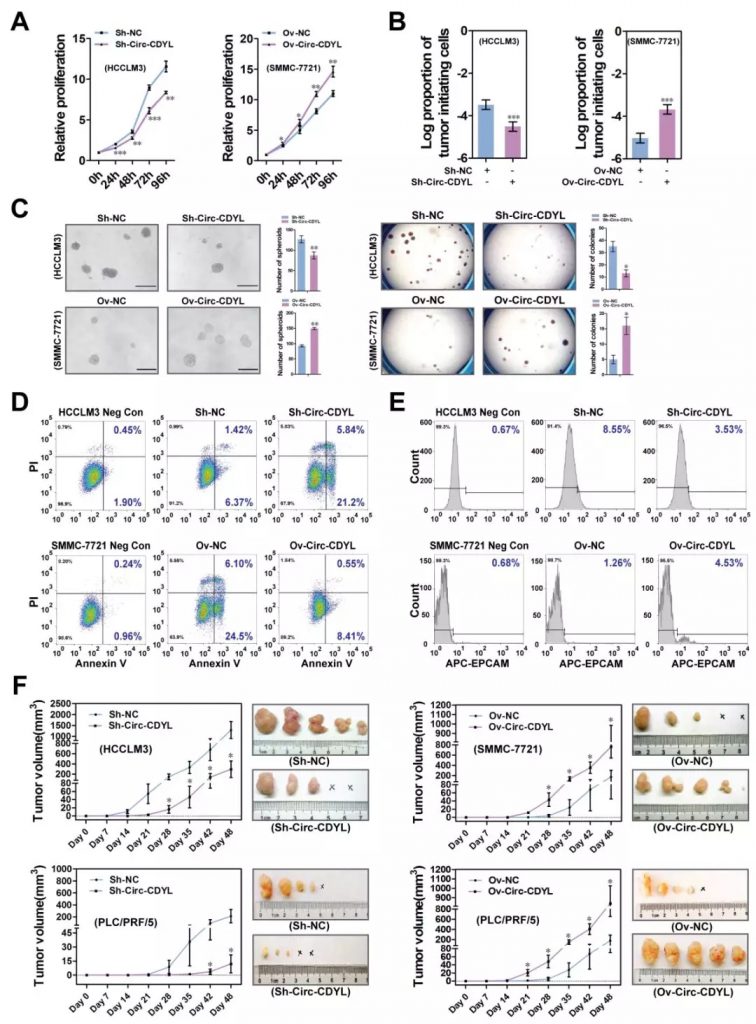
然后,研究者对Circ-CDYL的作用机制进行了探讨。Lucifearse报告基因实验、miRNA pull-down实验、结合位点阻断实验证实HDGF和HIF1AN的3’UTR区分别含有miR-892a作用元件和miR-328-3p作用元件,然而miRNA和靶向mRNA之间不存在负相关关系。
相反,Pearson相关性分析、Circ-CDYL敲低和过表达实验、HDGF和HIF1AN干扰实验、FISH共定位实验、结合位点阻断实验结果表明,Circ-CDYL通过ceRNA机制调控HDGF和HIF1AN的表达,该机制依赖于miR-892a和miR-328-3p。
进一步的下游信号通路研究显示,Circ-CDYL上调HDGF 和HIF1AN表达,分别激活PI3K-AKT-mTORC1/β-catenin信号通路和抑制HIF1AN下游的NOTCH2信号通路,增强了癌蛋白MYC和SURVIVIN表达,从而促进早期肝癌的发生发展。
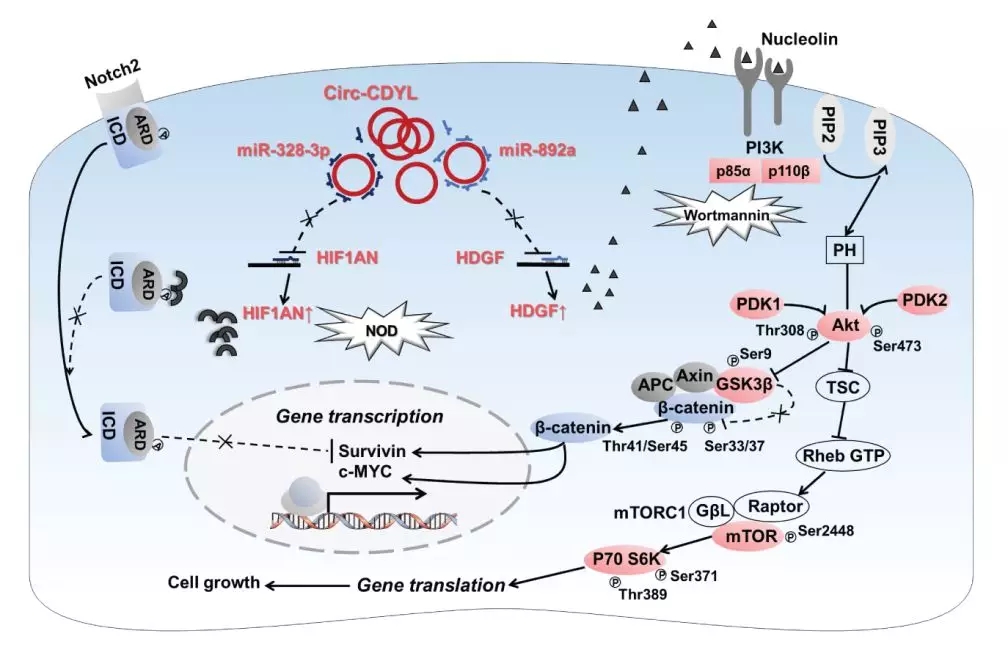
最后,研究者探索了Circ-CDYL在肝癌早期治疗和诊断上的潜在应用价值。使用PI3K抑制剂Wortmannin或者HIF1AN抑制剂NOD处理,可以阻断由Circ-CDYL引起的MYC和SURVIVIN表达上调,而且两种抑制剂联合使用效果最佳。
并且,如果在使用两种抑制剂的同时,干扰Circ-CDY表达,可以最大程度的抑制MYC和SURVIVIN表达,有效降低EPCAM+ T-ICs 的比例,实现对肝癌细胞生长和增殖的最佳抑制效果。
在肝癌早期诊断方面,ROC分析显示,Circ-CDYL、HDGF或HIF1AN三个分子分别呈现出良好的灵敏度和特异性,而且三种分子联用效果最佳,其灵敏性高达75.36%和特异性高达66.67%。
研究意义
本研究通过cirRNA、mRNA和miRNA表达谱芯片筛选出一个在肝癌早期特异性高表达的cirRNA:Circ-CDYL,并构建了由Circ-CDYL驱动的ceRNA网络。Circ-CDYL 通过吸附miR-892a和miR-328-3p,分别促进HDGF和HIF1AN的表达,激活HDGF下游的PI3K-AKT-mTORC1/β-catenin信号通路和抑制HIF1AN下游的NOTCH2信号通路,上调癌蛋白MYC和SURVIVIN,从而促进早期肝癌的发生、发展进程。
重要的是,本研究在肝癌早期诊断和治疗上提供了有价值的线索:干扰Circ-CDYL表达,同时联合使用靶向PI3K和HIF1AN分子的抑制剂Wortmannin和NOD,可高效抑制肝癌细胞的生长;Circ-CDYL、HDGF和HIF1AN三分子联用在诊断早期肝癌上呈现出了较高的灵敏度和特异性。
作者及单位介绍
国家肝癌科学中心为国家肝癌科学公共服务平台、国家学术交流和高层次肝癌研究人员培养基地,为肿瘤的综合性和个性化治疗提供理论基础,努力推动技术创新和成果的转化,为满足国家在“人口与健康”方面的重大需求做出贡献。这是继国家纳米中心之后,由国家发改委立项申批的第二个国家级科学中心。中心将紧紧围绕“显著降低我国肝癌发病率、病死率”这一目标,建设成为国家肝癌集成研究中心、国家肝癌研究优势资源共享平台、高层次肝癌研究人才培养基地、国家肝癌科学的公共服务平台、国际学术交流与合作中心。
本文的通讯作者是东方肝胆外科医院、国家肝癌科学中心王红阳院士,李亮副研究员为本文共同通讯作者,第一作者是危晏平硕士。
王红阳院士是我国肿瘤学、分子生物学著名专家,是教育部长江特聘教授、中国工程院院士。现任国家肝癌科学中心主任、国际合作生物信号转导研究中心主任,兼任中国医师协会精准医学专业委员会主任委员。
李亮副研究员毕业于海军军医大学海军临床医学系,先后任海军南海舰队166舰舰艇军医、东方肝胆外科医院助理研究员,现为国家肝癌科学中心副研究员,兼任中国抗癌协会肿瘤转移专业委员会青年委员,曾获上海市青年科技启明星、全军优博及海军军医大学“吴孟超式优秀青年”。
参考文献:A Noncoding Regulatory RNAs Network Driven by Circ-CDYL Acts Specifically in the Early Stages Hepatocellular Carcinoma. Hepatology. 2019 May 30. doi: 10.1002/hep.30795. [Epub ahead of print]





来第一个抢占沙发评论吧!