转自: 纽创医学Bio-SCI(微信公众号)
病理性血管生成是疾病的重要组成部分,如眼部疾病,癌症和动脉粥样硬化。它通常是由生物过程的异常活动引起的,如细胞增殖、细胞运动、免疫或炎症反应。长非编码RNA(LncRNAs)已经成为这些生物过程的关键调节因子。然而,lncRNA在糖尿病诱导的微血管功能障碍中的作用在很大程度上是未知的。
研究结果
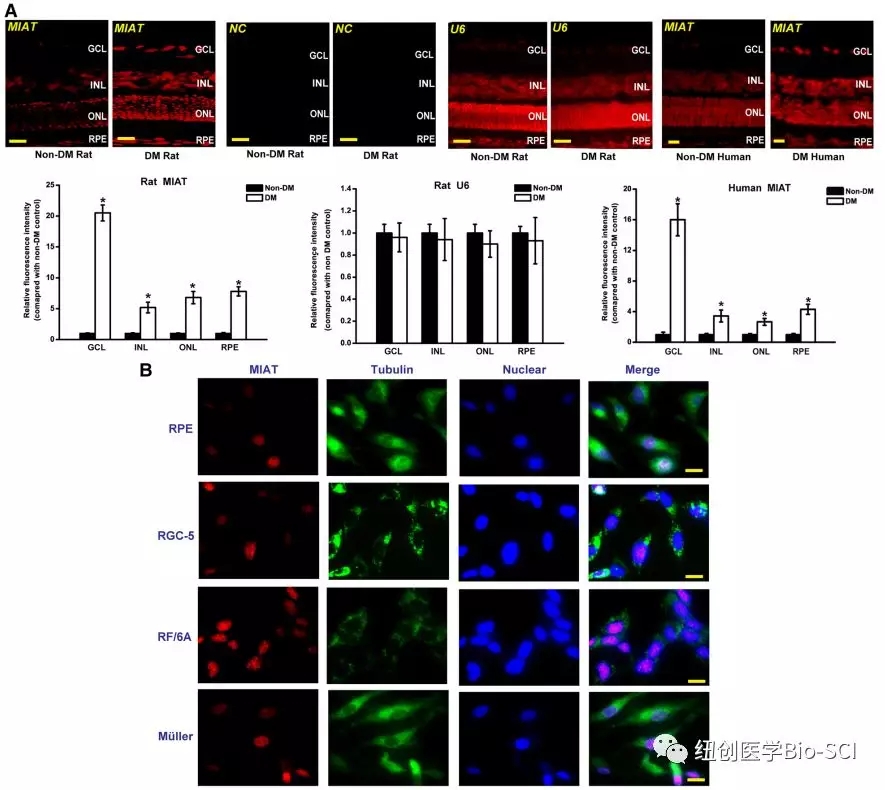
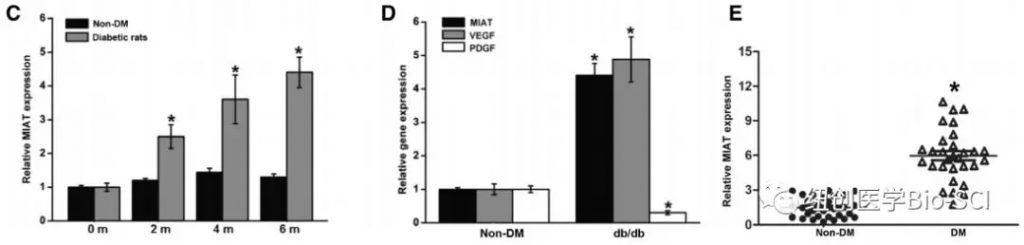
图1
图1:长非编码RNA-心肌梗死相关转录本(MIAT)的体内和体外表达模式。
A:用RNA荧光原位杂交(FISH)检测MIAT的表达。样品还与MIAT正义探针(阴性对照[NC])和U6探针杂交,以确认RNA-FISH特异性。对神经节细胞层(GCL)、内核层(INL)、外核层(ONL)和视网膜色素上皮(RPE)层进行50μm RNA-FISH定量,以显示非糖尿病组和糖尿病组之间MIAT表达的差异。
B:RNA-FISH检测视网膜细胞中MIAT的表达。细胞核,蓝色;MIAT,红色;微管蛋白,绿色。检测微管蛋白作为细胞质标记物来显示细胞边界。采用Scale bar,10μm.
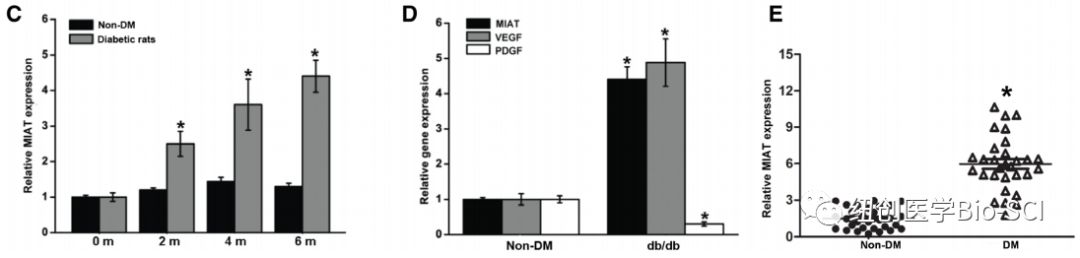
C:定量逆转录聚合酶链反应(qRT-PCR)检测糖尿病诱导后2,4,6个月大鼠视网膜中MIAT水平。
D:qRT-PCR检测db/db小鼠及其非糖尿病对照组视网膜中MIAT、血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF)的水平。
E:qRT-PCR检测不同临床样品中的MIAT水平。DM表示糖尿病。
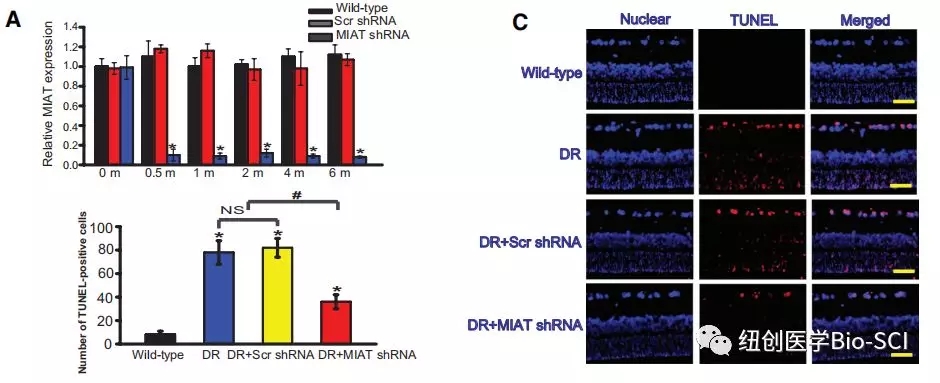
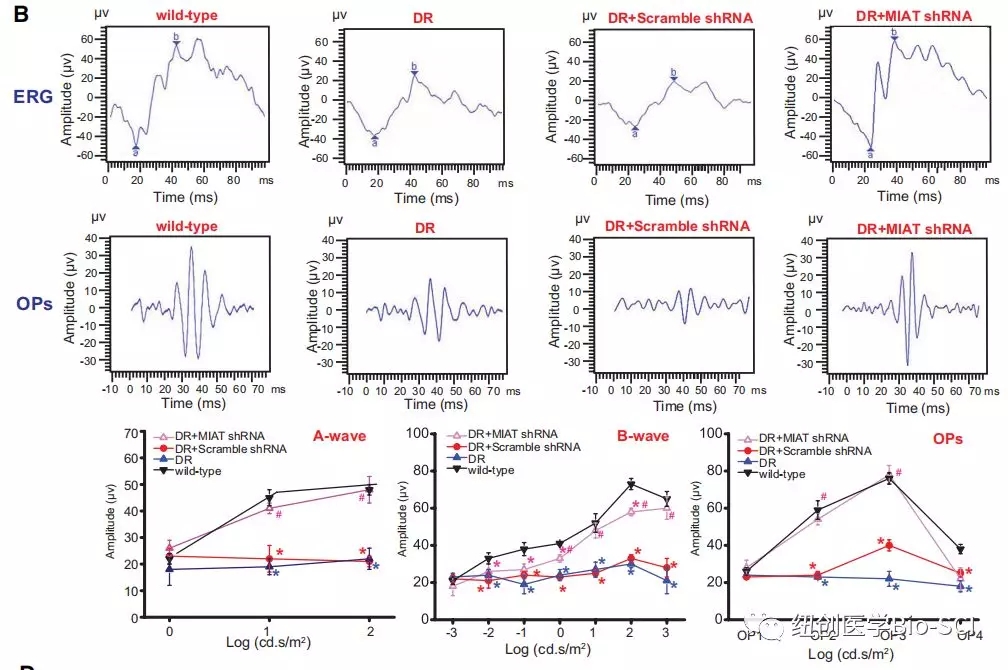
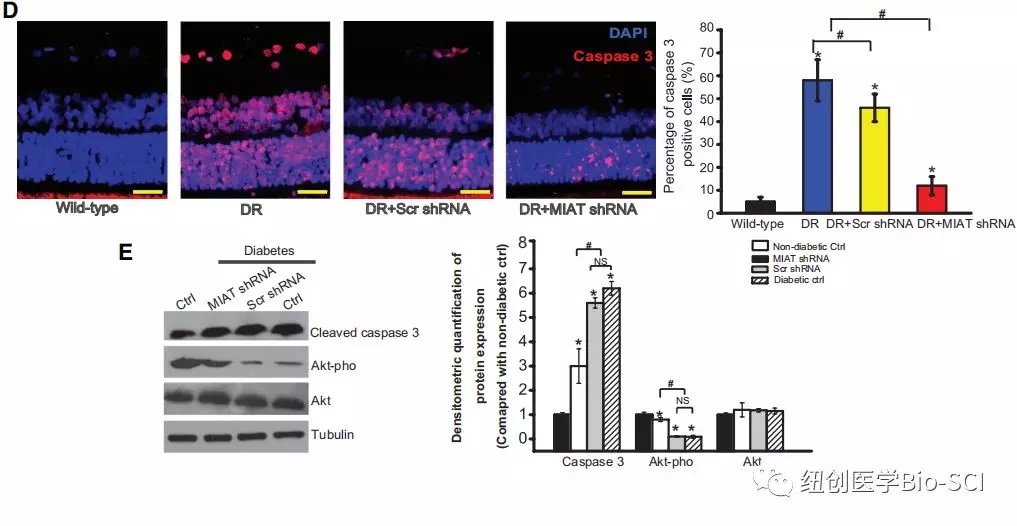
图2
图2:心肌梗死相关转录本(MIAT)敲除可改善视网膜功能。
A:组大鼠玻璃体腔内注射10μL Ad-SCR shRNA或MIAT shRNA病毒载体,观察时间。采用定量逆转录聚合酶链反应检测MIAT水平。
B:糖尿病诱导后6个月,记录非糖尿病大鼠(野生型)、糖尿病大鼠、注射Ad-SCR shRNA的糖尿病大鼠和注射Ad-MIAT shRNA的糖尿病大鼠的视网膜电图(ERG)。显示了具有代表性的ERG和振荡电位(OPs)波。对a,b,ops波的振幅进行统计学分析。*与野生型非糖尿病组比较有显著性差异。#DR组与DR+MIAT shRNA组有显著性差异。
C:显示糖尿病诱导6个月后TUNEL检测的代表性图像和定量结果。细胞核,蓝色;TUNEL阳性细胞,红色。比例尺,50μm。*与野生型非糖尿病组相比有显著性差异。#标记实验组之间有显著性差异。
D:对活化的caspase-3进行免疫荧光分析,以评估视网膜细胞凋亡。展示了一个有代表性的图像。比例尺,50μm.
E:Western blotts检测裂解的caspase-3,磷酸化Akt(Akt-pho)和总Akt的水平。检测微管蛋白作为负载对照。显示了具有代表性的免疫印迹和定量结果(n=4)。
1、DAPI:6-二胺基-2-苯基吲哚;
2、DR:糖尿病视网膜病变;
3、NS:无显著性差异。
4、*:与非糖尿病组相比有显著性差异。
5、#:被标记组之间的显著差异。
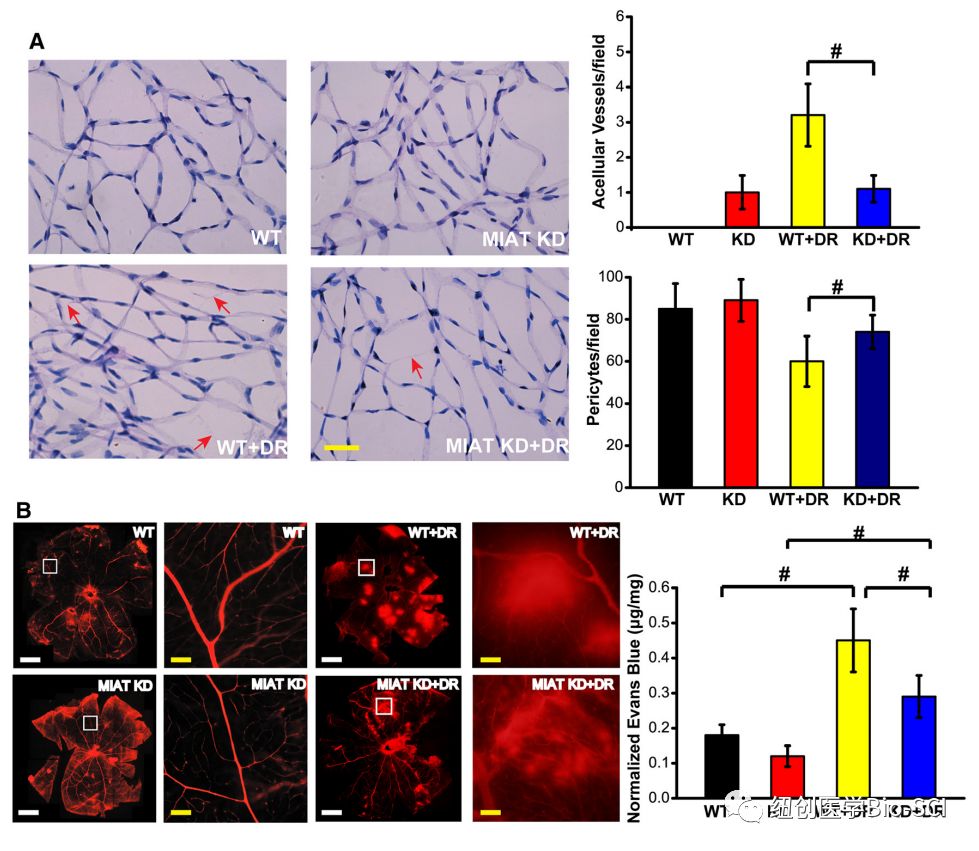
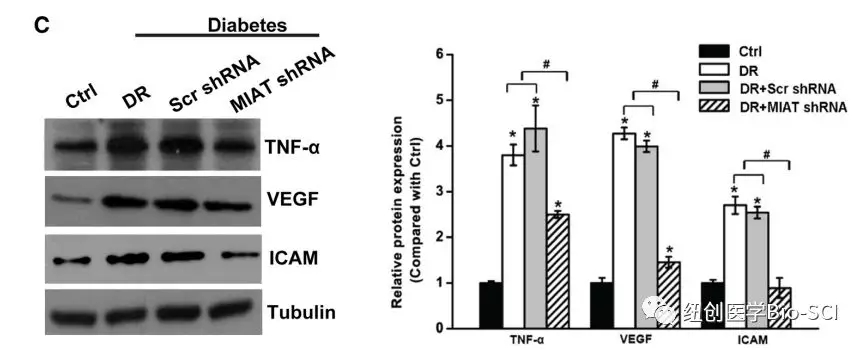
图3
图3:心肌梗死相关转录本(MIAT)敲除减轻视网膜血管损伤。
A:进行视网膜胰蛋白酶消化,检测周细胞和脱细胞毛细血管的变化。红色箭头表示无细胞毛细血管。周细胞和脱细胞毛细血管在每视网膜30个随机场中定量,并取平均值。比例尺,25μm.
B:大鼠灌注伊文思蓝染色2小时。用荧光显微镜检测平台式视网膜的荧光信号。展示了一个有代表性的图像。同时,对伊文思蓝渗漏进行量化。白色瘢痕条,100μm;黄色瘢痕条,25μm.
C:Western blotts检测肿瘤坏死因子-α,血管内皮生长因子和细胞间粘附分子-1的表达。检测微管蛋白作为负载对照。显示有代表性的免疫印迹和定量数据(n=4)。
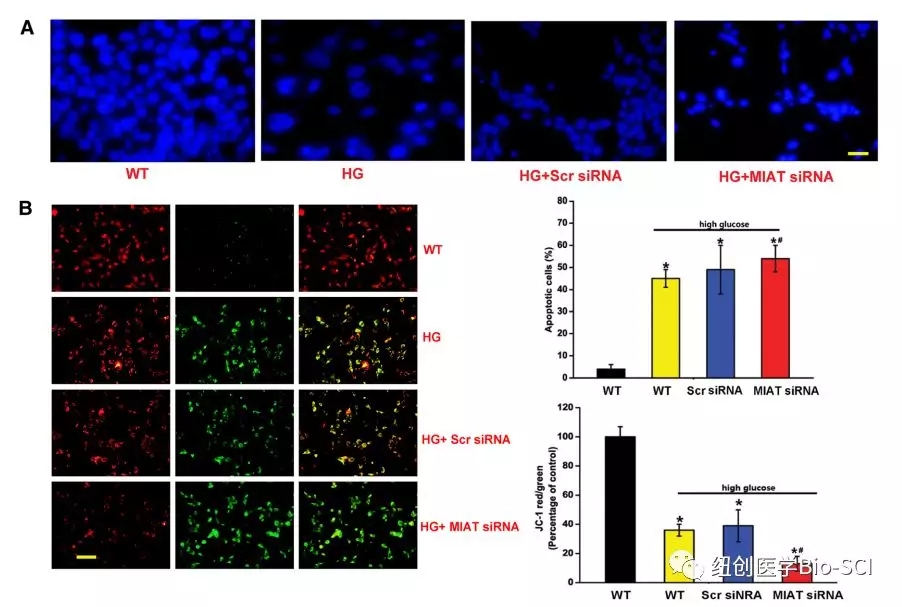
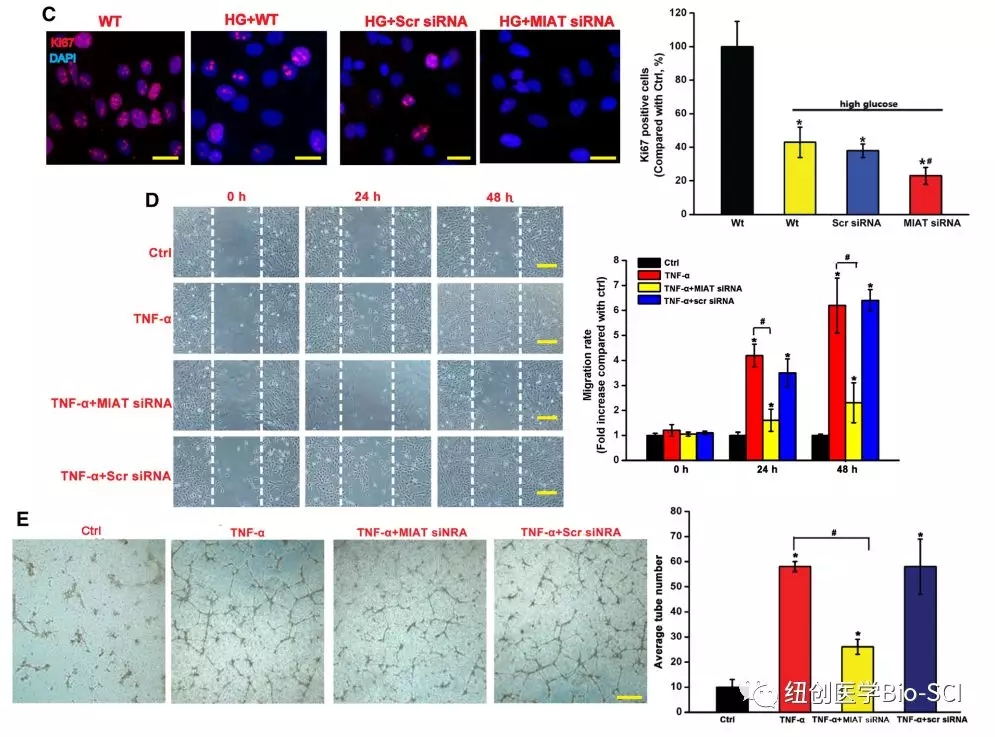
图4:心肌梗死相关转录本(MIAT)敲除在体外影响内皮细胞功能。
B:RF/6A细胞与JC-1探针在37°C孵育30分钟,离心,洗涤,转移到96孔板上,使用荧光板阅读器进行测定,并使用荧光显微镜进行观察。比例尺,50μm.
C:显示Ki67染色的代表性图像以及Ki67阳性细胞的定量。Scale bar,10μm.
D:用伤口愈合实验评估细胞迁移。在肿瘤坏死因子-α(10 ng/mL)处理后0、24和48小时拍摄图像。水平线表示伤口边缘。通过测量受伤区域内的细胞数量来估计迁移。数据显示为与对照组相比的相对变化,未进行肿瘤坏死因子-α治疗。将10 0μm.
E:RF/6A细胞接种于基质上,用肿瘤坏死因子-α(10 ng/mL)刺激。肿瘤坏死因子-α处理24h后观察管状结构。对每一场的平均管形成数进行统计学分析(n=50)。比例尺,100μm。
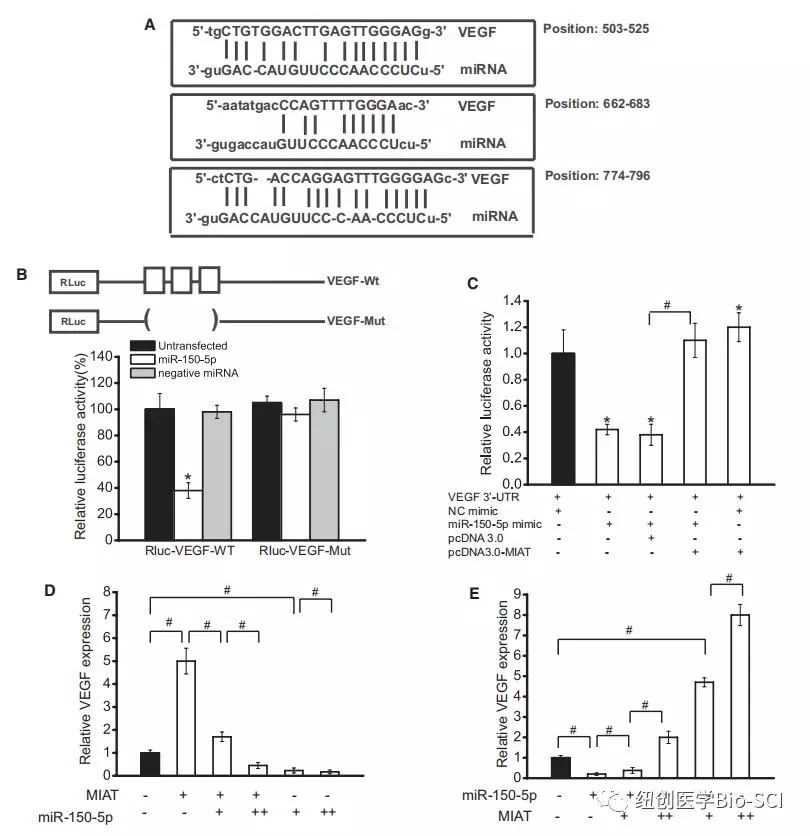
图5
图5:心肌梗死相关转录本(MIAT)调节miR-150-5p靶基因血管内皮生长因子(VEGF)的表达。
A:用miRTarBase预测VEGF为miR-150-5p的靶基因。显示了miR-150-5p结合位点在血管内皮生长因子上的位置(转录本ID:NM_0010253)。
B:VEGF(RLuc-VEGF-WT)和突变体(RLuc-VEGF-Mut)被克隆到荧光素酶载体的下游。荧光素酶活性检测采用双荧光素酶测定法。
C:rLuc-VEGF-WT和miR-150-5p与MIAT质粒或载体共转染RF/6A细胞,以验证MIAT的竞争内源性RNA活性。直方图显示转染48小时后测得的荧光素酶活性数据。
D和E:RF/6A细胞转染不同组合的MIAT和miR-150-5p模拟。采用定量逆转录聚合酶链反应(RT-PCR)检测VEGF的表达。(+)对应于100 ng的MIAT结构或20 ng的miR-150-5p模拟。(+)相当于200 ng MIAT结构或50 ng miR-150-5p模拟。数据显示为均值±扫描电镜,并表示为与对照组相比的相对变化(n=4)。对照组显示为黑色。
总结
这项研究突出了lncRNA-MIAT在病理性血管生成中的参与,并促进了针对新生血管疾病的lncRNA导向诊断和治疗的发展。
DOI: 10.1161/CIRCRESAHA.116.305510.
参考文献[1].Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis. Nature. 2011;473:298–307. doi: 10.1038/nature10144.
[2]. Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis. Cell. 2011;146:873–887. doi: 10.1016/j.cell.2011.08.039.
[3].Carmeliet P, Jain RK. Principles and mechanisms of vessel normalization for cancer and other angiogenic diseases. Nat Rev Drug Discov. 2011;10:417–427. doi: 10.1038/nrd3455.
[4]. Rinn JL, Chang HY. Genome regulation by long noncoding RNAs. Annu Rev Biochem. 2012;81:145–166. doi: 10.1146/ annurev-biochem-051410-092902.
[5].Michalik KM, You X, Manavski Y, Doddaballapur A, Zörnig M, Braun T, John D, Ponomareva Y, Chen W, Uchida S, Boon RA, Dimmeler S. Long noncoding RNA MALAT1 regulates endothelial cell function and vessel growth. Circ Res. 2014;114:1389–1397. doi: 10.1161/ CIRCRESAHA.114.303265..




来第一个抢占沙发评论吧!