转自: 生信菜鸟团(微信公众号)
circRNA的环化绝大多数发生在转录后,受到RNA聚合酶II(Pol II)、包括由顺式作用元件、反式作用因子和RNA结合蛋白组成的核心剪切机制调控发生。由于共价闭合结构,circRNA不受核酸外切酶的影响,但是降解过程机制尚不明确。目前,主要猜想包括:核酸内切酶参与的降解途径、通过完全互补结合miRNA由Ago2介导的降解途径以及m6A修饰涉及的circRNA降解途径。本篇将延续上一篇内容,重点概括转录后circRNA所行使的复杂功能。
abbreviation
epithelial-mesenchymal transition (EMT)
splice site (ss)
intronic complementary sequences (ICSs)
RNA binding proteins (RBPs)
N6-methyladenosine (m6A)
7-methylguanosine (m7G)
internal ribosome entry sites (IRESs)
circRNA复杂表达概述
已有报道显示,超过10%的测试细胞及组织中都涉及circRNA表达,但一般都处于较低水平。只有少部分circRNA较他们的线性转录本更为丰富,而这些circRNA表达与其关联的线性异构体 (isoforms)表达并不相关。此外,哺乳动物的细胞和组织中circRNA的表达模式并不一致,circRNA能够显著富集于某些组织的特定过程,比如人类大脑中的上皮 - 间质转化 (EMT) 过程。circRNA的反向剪切通常依赖于内含子互补序列 (ICSs)出现在环化外显子侧翼的内含子序列中,而重复序列在不同物种的进化中具有偏好性,因此进一步导致了circRNA表达的复杂性,比较发现,仅有的人类和平行小鼠样本的circRNA表达中仅有一小部分 (10%~20%)是相同的。
在单个基因表达水平,研究发现,一个的基因座能够通过可变剪切以及可变剪切位点的选择产生多个circRNA (Figure 1C),而一个circRNA能够包含不同数量的外显子序列。产生circRNA过程中经典的可变剪切能够分为以下4种类型:盒式外显子 (cassette exon), 内含子保留 (intron retention), 可变5'剪切 (alternative 5' splicing), 以及可变3'剪切 (alternative 3' splicing)。通过以上方式产生于同一个基因座的circRNAs具有相同的反向剪切位点 (back ss),但是每一个circRNA都包含不同的经典剪切位点 (canonical ss) (Figure 1C)。可变反向剪接的选择及circRNA特异的可变剪切的选择将会进一步丰富外显子的种类,而这些新的盒式外显子主要参与circRNA中的可变剪切,几乎不转录线性mRNA,但是剪切子如何准确识别外显子能否环化的机制仍需要进一步探究。
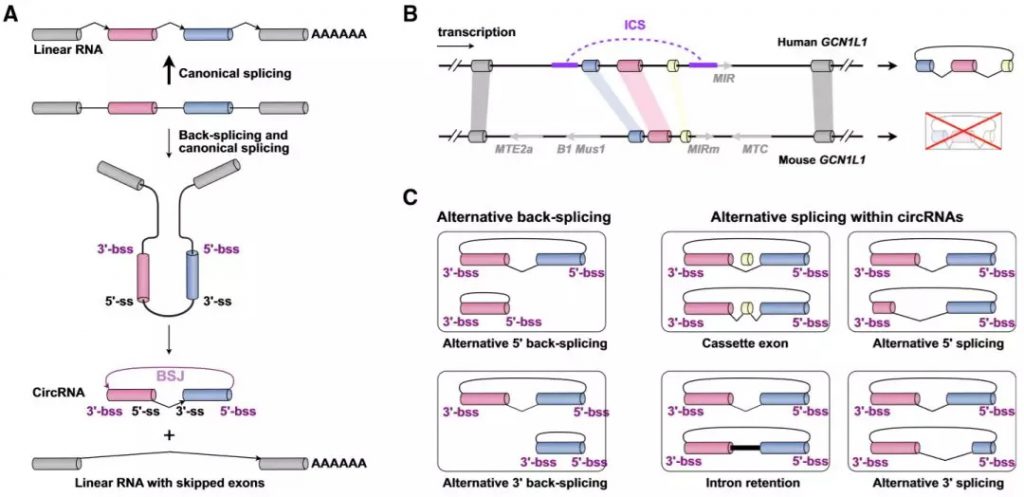
Figure 1. Complexity of circRNA Expression [1] (A) Back-splicing for circRNA biogenesis. Pre-mRNA undergoes either canonical splicing to generate a linear RNA (top) or back-splicing with low efficiency to produce a circRNA and an alternatively spliced linear RNA with exon exclusion (bottom). ss, splice site; bss, back splice site. (B) Conservation of circRNA expression. Although the conservation of circRNA-forming exonic sequences in the GCN1L1 locus is high between human and mouse, circGCN1L1 is clearly detected in humans but barely in mice, largely because of the existence of intronic complementary sequences (ICSs) in the human but not the mouse locus. (C) Alternative back-splicing and alternative splicing in circRNAs. There are two types of alternative back-splicing and four basic types of alternative splicing in circRNAs. See text for details.
circRNA功能
尽管circRNA的表达普遍偏低,并不是真核转录组中的主要成员,但是由于其特殊的拓扑结构circRNA在某些特殊的时空中发挥了重要作用,涵盖生理和病理过程。目前在动物研究中所涉及的功能如下:
-
调控转录及剪切过程
由于绝大多数的circRNA来源于编码基因的外显子,这些过程能够通过竞争外显子来影响mRNA前体的剪切过程,从而进一步改变基因表达(Figure 2, I)。虽然绝大多数的circRNA都定位在细胞质,但是通过内含子套索的 ciRNAs或保留内含子反向剪切获得的 EIciRNAs 都只在核内活动,而这些核限定circRNA能够在转录和剪切水平上调节基因表达 (Figure 2, II, III)。
-
编码蛋白
虽然大多数内源性circRNA不与核糖体结合进行翻译,但是最近的几项研究表明,一小部分circRNA具有编码潜能。由于缺乏帽子和poly(A)尾巴,circRNA并不能依赖经典的m7G帽子结构途径进行翻译。研究发现,当内部核糖体进入位点(IRES)元件插入到起始密码子 AUG 的上游时,能够启动翻译(Figure 2, VI)。除了IRES途径,N6-甲基腺苷(m6A)修饰能够直接影响circRNA翻译过程。虽然不依赖帽子的翻译方式效率较低,但circRNA编码过程一般都发生在逆境条件下,可能作为实现某些功能的补充。
-
circRNA驱动的假基因
假基因一般由反转录的线性mRNA插入来源基因组产生,通过对人类及小鼠参考基因组中非共线的反向剪切接头序列重新检索,已经鉴定到数十种由circRNA驱动的假基因,这些插入的反转录circRNA能够破坏来源基因组的完整性。但是circRNA逆转录分子机制尚不清楚(Figure 2, VII)。
-
miRNA海绵及蛋白互作
内源性竞争RNA能够改变自身丰度通过miRNA海绵的方式调节miRNA的活动(Figure 2, IV),研究显示circRNA也具有该功能。值得注意的是,与靶miRNA的结合方式不同,可能会导致不同的基因命运。由于哺乳动物中大多数circRNA都处于低水平表达,并且只有少部分的circRNA预测能够获得一个或者多个miRNA结合位点,因此miRNA sponge似乎并不是circRNA普遍通用的功能实现方式。此外,circRNAs能够与不同的蛋白质相互作用形成特定的circRNPs,改变相关蛋白质的构象从而发挥调控作用 (Figure 2,V),最新的研究表明,许多circRNA在正常细胞中能够作为储备物以便在特殊过程中快速中断效应蛋白。
-
生物标记物
越来越多的证据显示,circRNA的表达具有时空组织特异性,参与各种生理病理过程。例如circRNA能够在哺乳动物大脑、神经细胞系中积累,其中在神经细胞发生过程中大部分circRNA上调,且相较于他们的线性转录本,circRNA更显著富集于突触中;多个癌症过程研究报道,某些circRNA可能影响癌症转移、侵袭等过程;circRNA参与先天免疫反应;而疾病相关的关键基因座所产生的circRNA同样参与人类疾病过程。由于结构特殊,circRNA不仅能够在细胞内和血浆(包括血液和唾液)中非常稳定,而且能够通过外泌体从细胞体转运到细胞外液,尽管还需确定circRNA是否能够调节远端组织和细胞中的基因表达,但是circRNA的特异表达仍能够作为一个新的潜在标志诊断物(Figure 2, VIII)。
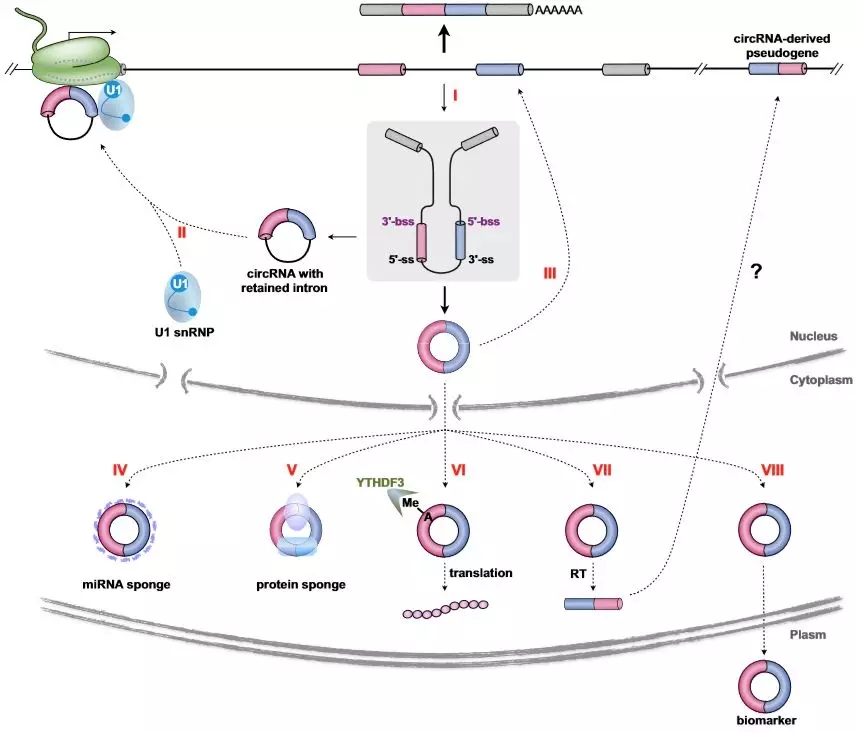
Figure 2. Potential Functions of circRNAs.[2] Endogenous circRNAs are involved in gene expression regulation through distinct mechanisms. I: the processing of circRNAs affects splicing of their linear mRNA counterparts. II: circRNAs can regulate transcription of their parental genes. III: circRNAs can regulate splicing of their linear cognates. IV: circRNAs can act as miRNA sponges. V: circRNAs can act through associated proteins. VI: circRNAs can be translated. VII: circRNAs are resources for derivation of pseudogenes. VIII: circRNAs are promising biomarkers.
小结
两篇学习专题笔记主要梳理了circRNA研究历史及最新的研究结果。虽然在表达丰度上不及其他真核转录本,但是circRNA在扩展真核生物调控复杂程度上扮演了不可或缺的角色。当然,还有诸多研究仍需进一步展开,例如circRNA降解途径、出核机制、反转录、编码蛋白等机制。下一篇笔记将对目前主流的circRNA研究思路进行一个概述,进一步加深对circRNA的理解。
主要参考文献
[1] Chen L L. The biogenesis and emerging roles of circular RNAs[J]. Nat Rev Mol Cell Biol, 2016, 17(4):205-211.
[2] Li, X., Yang, L., & Chen, L. L. (2018). The biogenesis, functions, and challenges of circular RNAs. Molecular cell.



感谢分享!!!