转自:健康科普讲堂(微信公众号)
- 肝细胞癌(HCC)免疫治疗新进展:阻断CXCL1-CXCR2趋化轴;
- HCC又一治疗靶点:环状RNA MAT2B;
- 直接抗病毒药物:可降低丙肝患者肝癌及死亡风险。
HCC免疫治疗新进展:
阻断CXCL1-CXCR2趋化轴
来自我国空军医科大学的研究者发现,HCC中受体相互作用蛋白激酶3(RIP3)的表达缺失通过趋化因子CXCL1-CXCR2轴导致髓源抑制细胞(MDSCs)的聚集,从而促进HCC免疫逃逸和进展。阻断趋化因子CXCL1-CXCR2轴可能成为RIP3缺失HCC的一种新的免疫治疗方法。该文章发表在Hepatology。
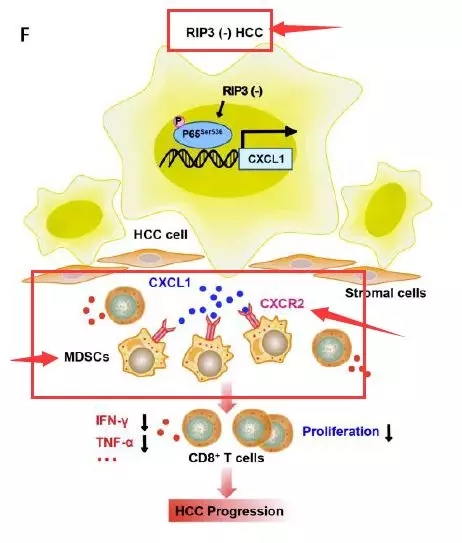
图1 RIP3-MDSCs免疫抑制机制
■ 肝癌患者肿瘤浸润性MDSCs对自身CD8+ T细胞有明显的抑制作用,RIP3与MDSCs呈负相关
RIP3是将细胞凋亡转化为坏死的核心调控因子,而其在肿瘤免疫中的作用尚不清楚。
研究者通过流式细胞术发现,与健康供者外周血相比,HCC患者的肿瘤、非肿瘤肝组织及外周血中MDSCs的表达均明显增高,而CD8+ T细胞明显降低,同时其与肿瘤浸润的MDSCs共培养后可被明显抑制,提示MDSCs可能通过抑制自体CD8+ T细胞来促进HCC免疫逃逸。
随后作者通过HCC肿瘤与非肿瘤肝组织的免疫组化发现,与正常肝脏组织相比,肿瘤组织中RIP3的表达水平明显降低,而MDSCs标志物CD11b表达上调,RIP3与CD11b呈负相关。提示RIP3低表达和MDSCs在HCC中的积累具有重要的临床意义。K-M曲线显示,RIP3低表达的患者总体生存率较低。
■ RIP3缺失促使MDSCs聚集从而导致肿瘤进展
作者将Hepa1-6细胞系原位接种到C57BL/6小鼠体内,发现RIP3敲除的肿瘤细胞MDSCs表达增加,IFN-γ+ CD8+T细胞比例降低,提示提示RIP3的缺失增加了MDSCs浸润,进而抑制了抗肿瘤免疫。
趋化分析显示,与Hepa1-6-shRIP3细胞共培养后,MDSCs的迁移指数明显升高。同时与对照相比,RIP3特异性拮抗剂GSK’872对RIP3的阻断也增加了MDSCs的迁移指数。均提示RIP3的缺失促进了MDSCs趋化。
随后作者在小鼠体内通过过继转移,发现联合注射RIP3敲低的肝癌细胞和MDSCs可显著增加肝癌的生长速度和肿瘤重量。提示RIP3缺失促进了HCC的进展和MDSCs的聚集。
■ RIP3缺失上调CXCL1并通过同源受体CXCR2诱导MDSC趋化
MDSCs侵袭实验表明,来自RIP3敲除细胞的培养基对MDSCs具有有效的趋化能力,同时作者发现与RIP3缺失引起的其他趋化因子相比,CXCL1是表达最丰富的趋化因子之一。通过检测RIP3和CXCL1的表达水平,作者发现RIP3和CXCL1呈显著的负相关。而后进一步通过流式、免疫荧光、趋化实验证实了RIP3的缺失上调CXCL1并通过其同源受体CXCR2诱导MDSCs趋化。
■ RIP3和CXCR2抑制剂联合应用可抑制MDSCs对肿瘤的趋化作用
随后作者建立HCC的小鼠模型,发现拮抗CXCR2可通过抑制MDSCs对肿瘤的趋化逆转免疫抑制,从而促进CD8+ T细胞的抗肿瘤作用。研究者进而通过RIP3敲除的小鼠HCC模型进一步证实RIP3缺失通过上调CXCR2配体使MDSCs聚集。同时小鼠的生存分析显示,阻断CXCR2可提高RIP3敲除小鼠的生存率。
作者发现在大多数HCC患者表现为RIP3缺失,RIP3的缺失促进CXCL1/ CXCR2诱导的MDSCs趋化,促进免疫逃逸和HCC进展。在敲除RIP3的小鼠中,CXCR2拮抗剂抑制MDSCs浸润并导致HCC延迟进展。同时该研究为我们提供了一个潜在的治疗靶点,即通过阻断MDSCs聚集治疗RIP3缺失HCC。
来自东南大学医学院的研究者发现,缺氧条件下,环状RNA MAT2B(circMAT2B)通过激活circMAT2B /miR-338-3p/PKM2轴,促进糖酵解以及HCC进展,该途径可能成为HCC治疗的新靶点。该研究结果发表在Hepatology。
糖代谢的重编程是多种恶性肿瘤的公认特征,其通过更快的糖酵解速率,在低氧环境中保持快速增殖以及大分子合成的需要。然而,这种转变机制仍有待阐明。
研究者从GEO的3个数据集(GSE97332、GSE94508、GSE78520)中找出了5种在HCC持续上调的环状RNA,最终通过50名HCC患者癌及癌旁的对比发现,circMAT2B(has_circ_0074854)在癌组织的转录显著增加并且差异最为显著,并随后通过100名HCC患者加以验证。
■ circMAT2B的高表达与HCC糖酵解有关
作者将100名HCC患者根据中位数分为circMAT2B高表达组50人,低表达组50人。高表达组肿瘤分期相对更晚,总生存期更短(HR=2.170,p=0.032)。提示circMAT2B过表达在HCC的进展中起重要作用。
进一步用高效液相色谱法(HPLC)测定了HCC患者血清中糖酵解和三羧酸(TCA)循环相关代谢物,糖酵解相关有机酸在circMAT2B高表达组中相对较高,而在TCA中两组无显著差异。
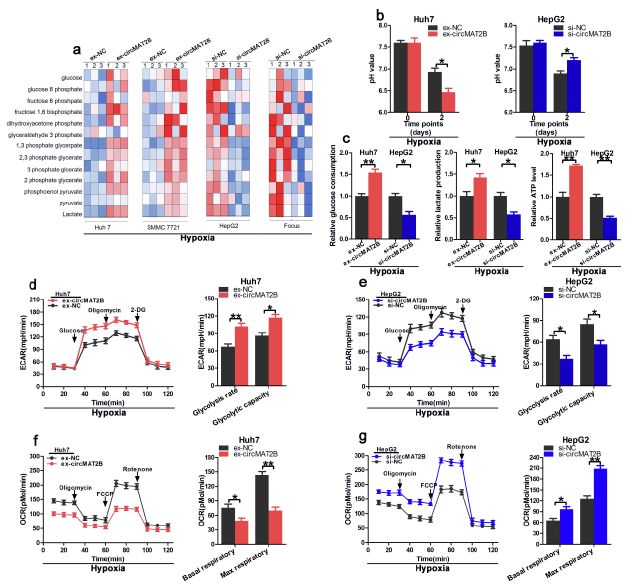
■ 在体外低氧条件下,circMAT2B促进糖酵解和糖酵解相关细胞的增殖、迁移和侵袭
作者通过慢病毒转染构建circMAT2B高表达细胞系(Huh7-circMAT2B、SMMC7721-circMAT2B)及低表达系(HepG2-si-circMAT2B、Focus-si-circMAT2B),并将其分别暴露于低氧(1%)环境中,发现过表达circMAT2B细胞系的糖酵解表型增加,而敲除circMAT2B的细胞系糖酵解表型减少。同时过表达系pH值下降更快,敲除组pH下降则被抑制。葡萄糖的摄取、产生乳酸和ATP的产生在高表达组均增加,在敲除组则相反。
低氧条件下测定细胞外酸化速率(ECAR)和耗氧量(OCR)发现,circMAT2B高表达细胞系中糖酵解能力和糖酵解速率显著提高,而在低表达细胞系中均降低。提示我们circMAT2B在低氧条件下促进糖酵解。
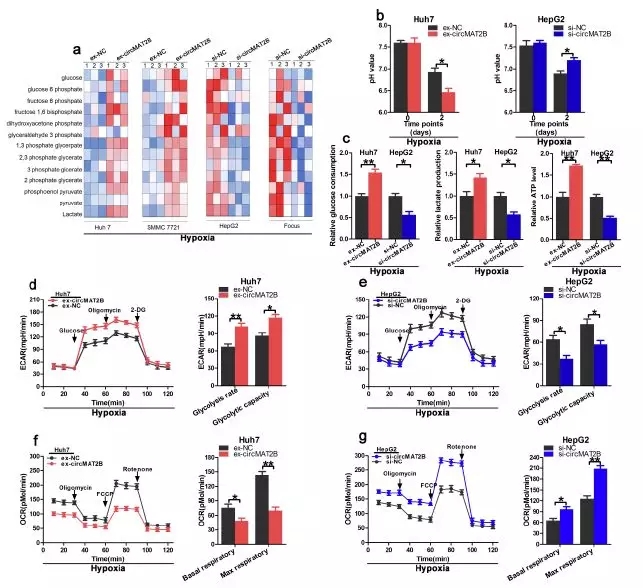
图2.在体外低氧条件下,circMAT2B促进糖酵解和糖酵解相关细胞的增殖、迁移和侵袭
研究者随后通过CCK-8、EdU和菌落形成实验表明,以及流式、创伤修复迁移、迁移实验证实了circMAT2B上调显著促进Huh7和SMMC7721细胞的增殖、迁移和侵袭,下调则与之相反。
■ circMAT2B的过表达增加了HCC体内葡萄糖的利用、肿瘤的生长和转移
作者将过表达circMAT2B细胞系Huh7以及敲除系HepG2分别予小鼠皮下注射成瘤,PET-CT予以评估糖代谢摄取,circMAT2B能显著促进裸鼠对18F-FDG的摄取,而敲除组则作用相反。过表达组肿瘤生长加快,肿瘤重量增加,敲除组与之相反。
同时作者还通过尾静脉注射Huh7和HepG2细胞到裸鼠构建转移模型。过表达circMAT2B增加了Huh7组的转移,而敲低circMAT2B则降低了HepG2组的转移。与对照相比,过表达组肺转移增加,总生存期缩短,而敲除组相反。这些结果均表明,circMAT2B在体内促进HCC葡萄糖利用、肿瘤生长和转移方面发挥着关键作用。
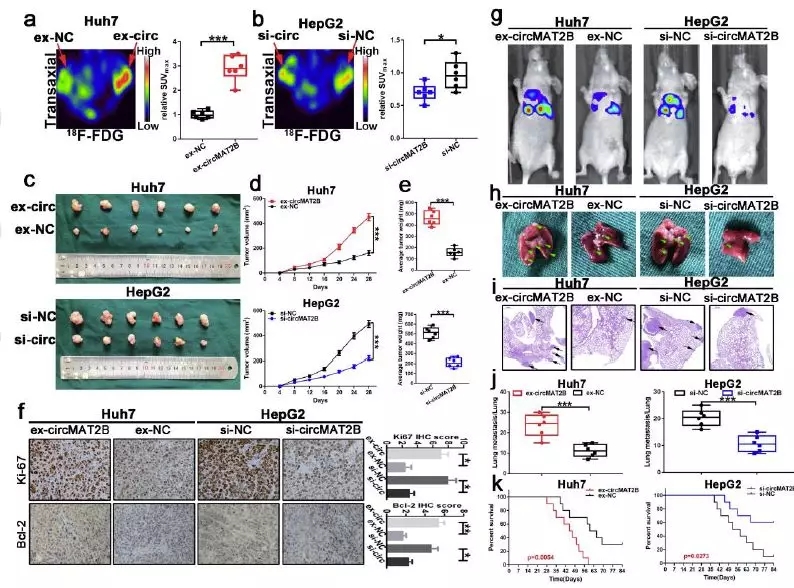
图3.体内条件下,circMAT2B的过表达增加葡萄糖的利用、肿瘤的生长和转移
随后研究者进一步揭示了circMAT2B促进无氧糖酵解及HCC进展的机制:通过上调miR-338-3p靶基因PKM2的表达水平(PKM2通过海绵吸附miR-338-3p编码糖酵解过程中的关键酶)。
回顾全文,作者通过体内外实验均证实了circMAT2B促进肝癌细胞糖酵解和HCC细胞的增殖、迁移和侵袭,并随后揭示其内在机制,为HCC的治疗提供了新的靶点。
直接抗病毒药物:
可降低丙肝患者肝癌及死亡风险
近期法国研究者对来自法国32家肝病中心的成年慢性丙型肝炎患者进行了前瞻性研究,结果显示直接抗病毒药物(DAA)治疗可降低死亡率和肝癌的风险,所有慢性丙型肝炎感染患者均应考虑。文章发表在Lancet。
虽然DAA已广泛用于治疗慢性丙型肝炎病毒(HCV)感染患者,但其临床疗效尚未得到很好的报道。
作者联合多家肝病中心,在法国ANRS CO22 Hepather慢性丙肝患者队列中比较了DAA治疗和未治疗的患者的全因死亡、肝细胞癌和失代偿性肝硬化的发生率。除外已经出现肝硬化失代偿、肝癌、肝移植以及使用干扰素-利巴韦林的患者。
自2012年8月6日至2015年12月31日,共有10166名患者符合研究条件。9895例(97%)患者有随访资料,纳入分析。患者中位年龄56岁,男性5279例(53%)。
7344名患者在入组后平均4.3个月开始DAA治疗。中位随访时间为33.4个月,2551例患者在最后一次随访时仍未接受治疗。接受DAA治疗的患者年龄更大,男性更多见,BMI更高。
随访期间,218例患者死亡(129例治疗,89例未经治疗),258例报告肝癌(187例治疗,71例未经治疗),106例肝硬化失代偿(74例治疗,32例未经治疗)。
经过变量调整后(年龄、性别、体重指数、地理来源、感染途径、纤维化评分、丙肝病毒首次治疗、HCV基因型、饮酒、糖尿病、动脉高血压、生物变量和肝硬化患者终末期肝病评分模型),DAA治疗可显著降低全因死亡率(调整后HR 0.48)及HCC发生率(调整后HR 0.66)。是否治疗与失代偿性肝硬化无显著相关性(调整后HR 1.14)。
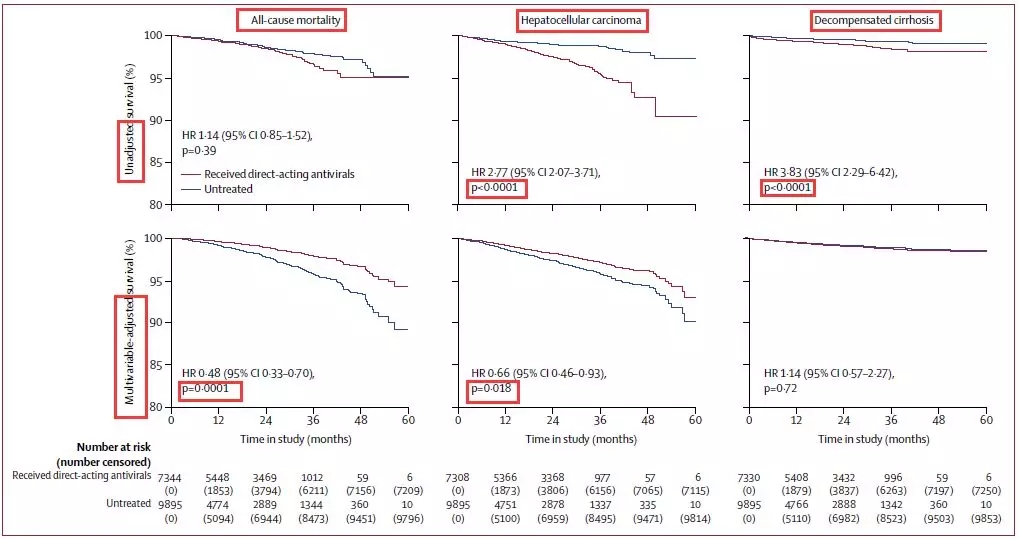
图4. DAA治疗与否的全因死亡率,HCC、肝硬化失代偿的发生在全体患者中的比较
该研究是第一个前瞻性调查临床转归与DAA治疗在慢性丙肝病毒感染患者中的关系,调整后的多变量分析表明,DAA治疗与全因死亡率和HCC发病率的迅速下降有关。作者认为,该研究结果还表明,DAA不会对肝癌的发展产生不利影响。但作者同时指出,DAA对肝脏失代偿的长期影响仍需进一步阐明。



来第一个抢占沙发评论吧!