转自:两个小齿轮(微信公众号)
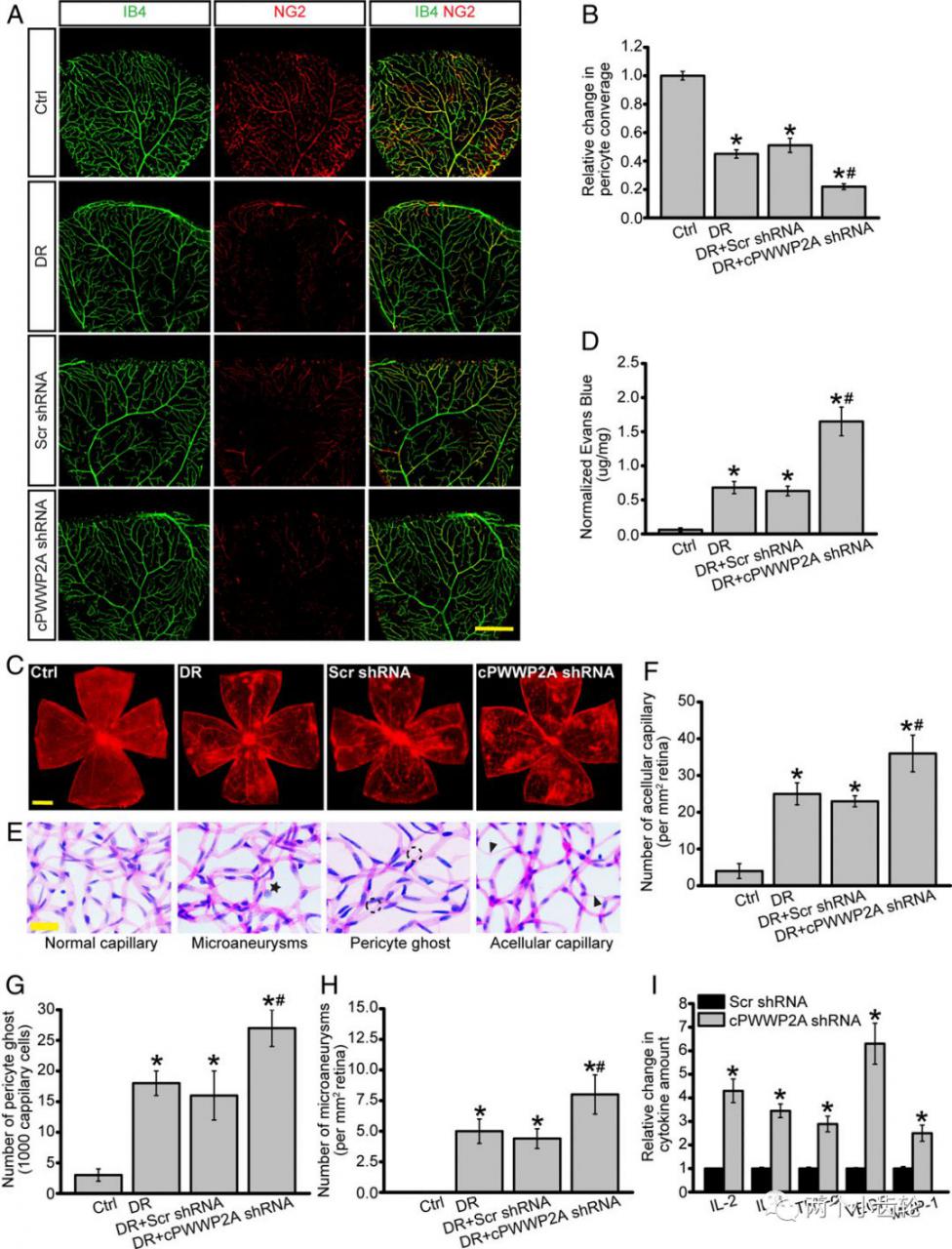
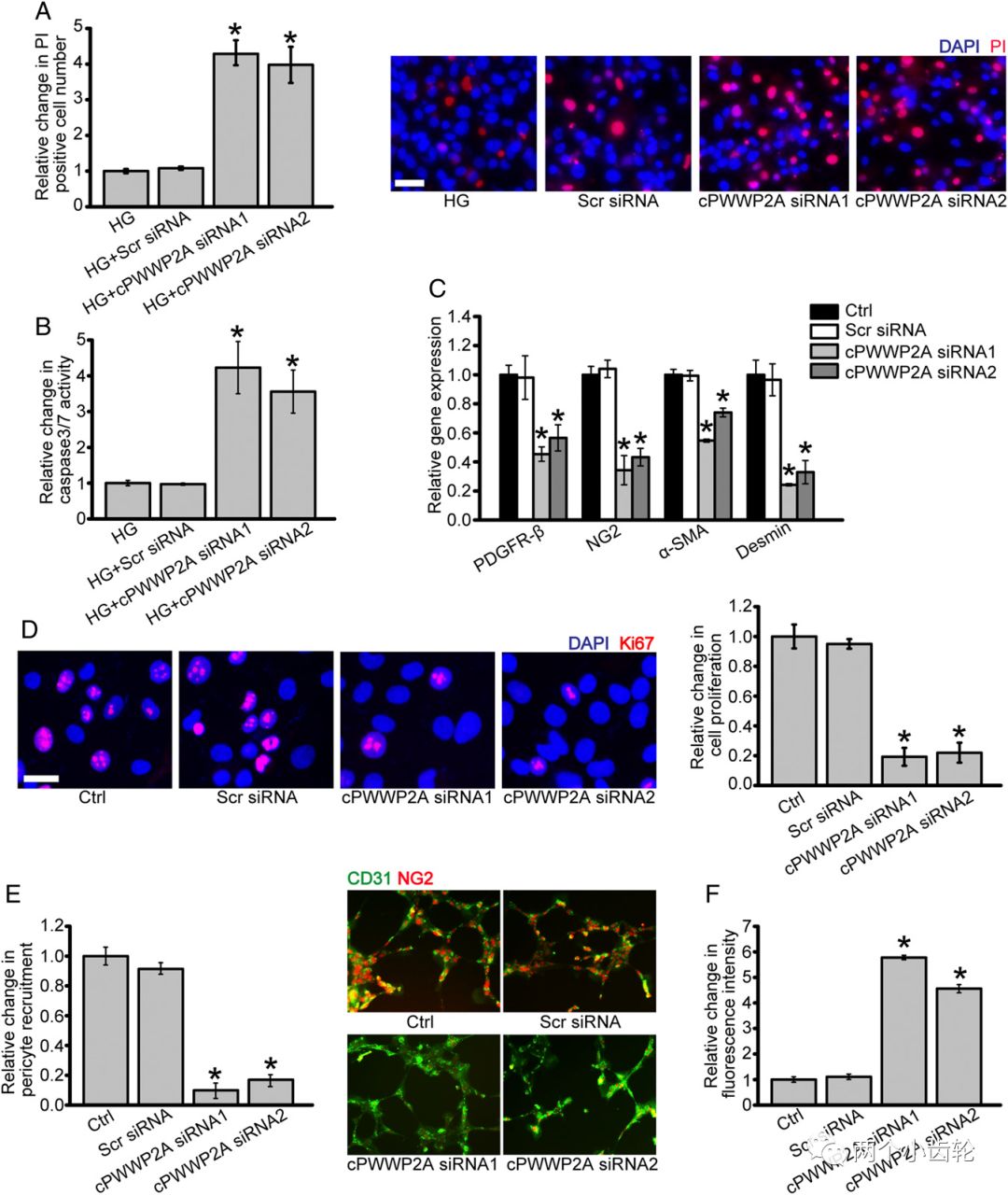
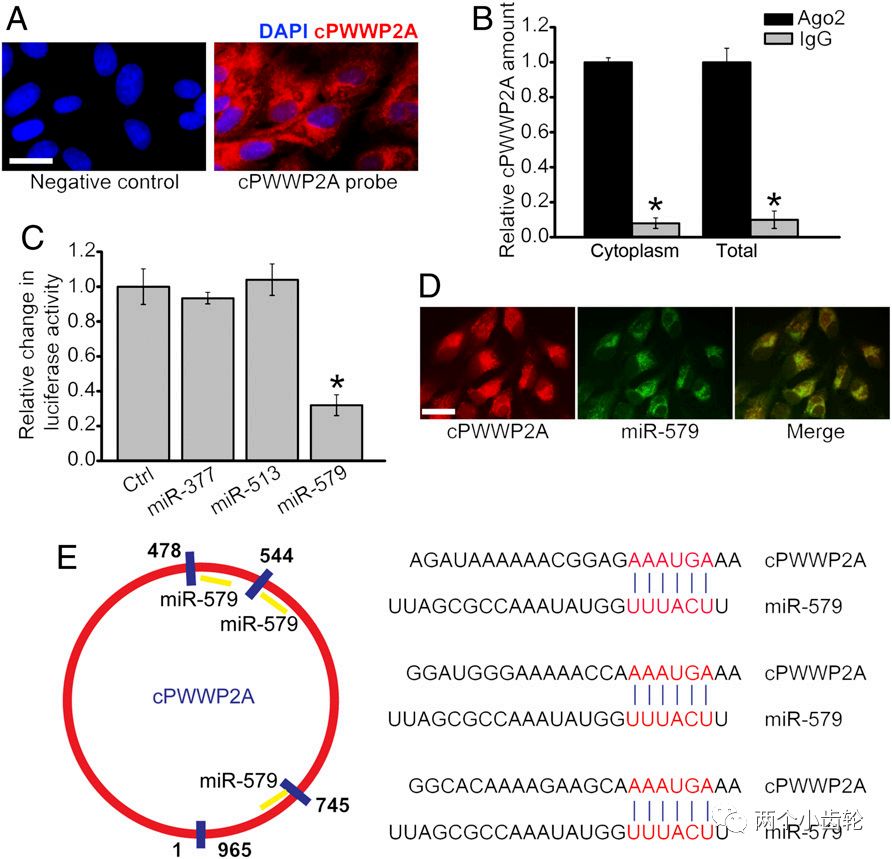
来自上海复旦大学附属眼耳鼻喉医院的赵晨团队和严彪团队于2019年4月9号合作发表在PNAS上的“Targeting pericyte-endothelial cell crosstalk by circular RNA-cPWWP2A inhibition aggravates diabetes-induced microvascular dysfunction”。该论文从环状RNA(Circular RNAs)的角度回答了这一问题。
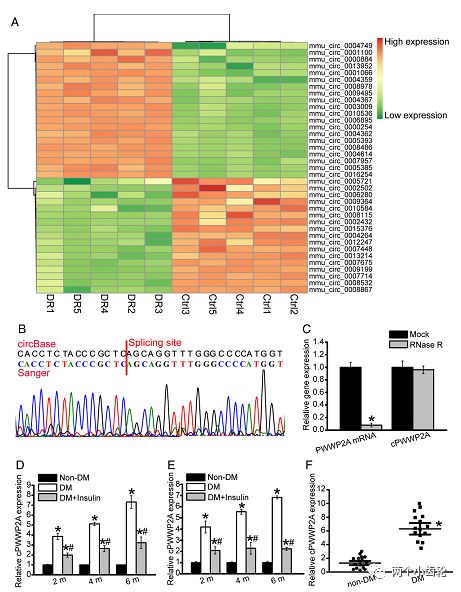
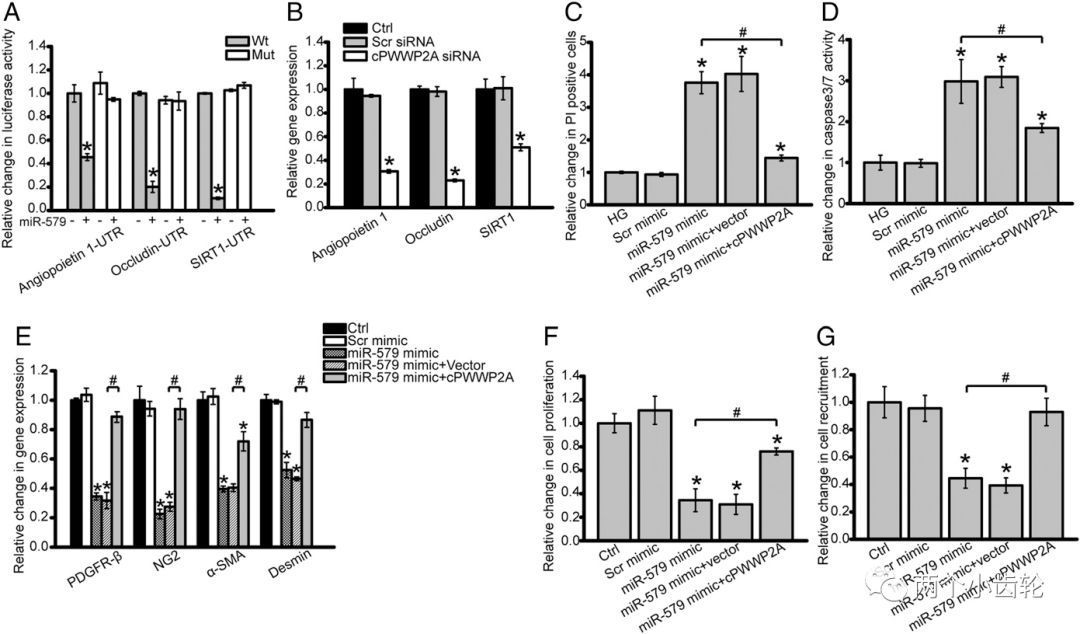
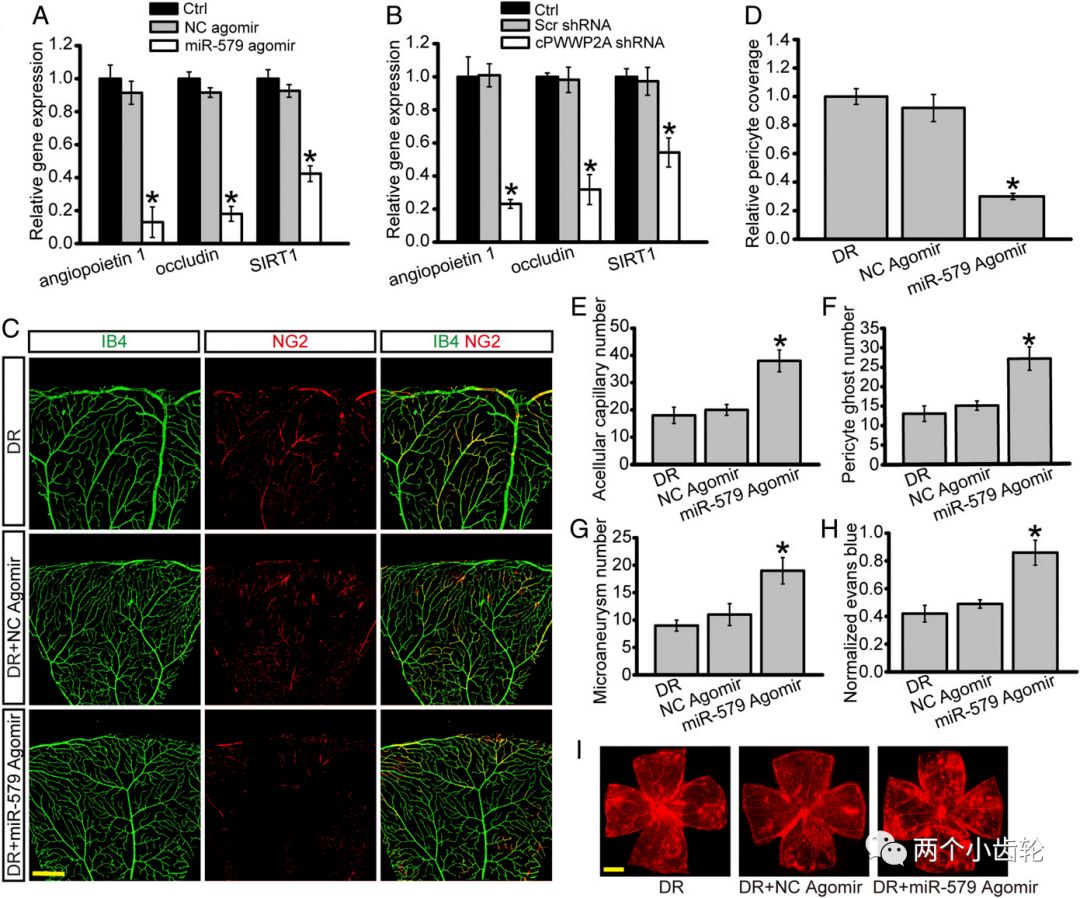
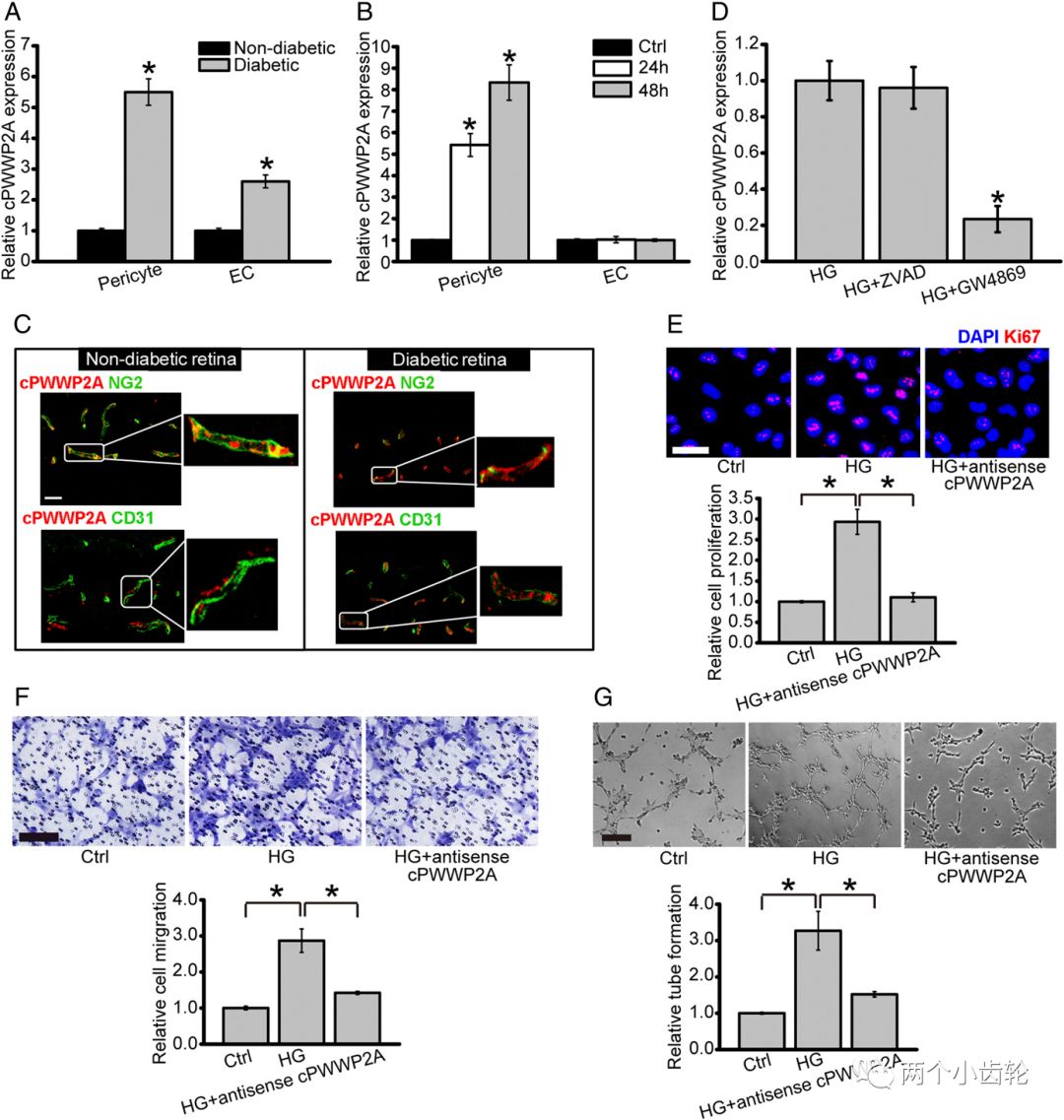
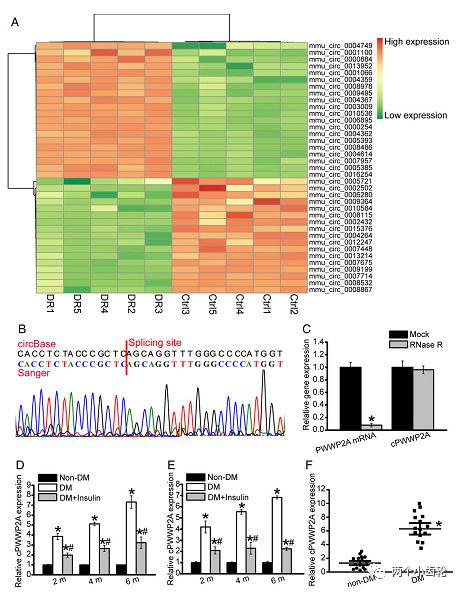
为了解糖网病中各种circRNAs的表达,研究者进行了circRNAs微整列表达谱分析,在844种circRNAs中发现433种上调,411下调,随机选取了20种上调和20种下调的circRNAs进行分群聚类分析,通过与人类基因库比对,选定cPWWP2A,再通过Sanger测序验证,且不可被RNA酶降解,进一步明确其为circRNA。qPCR的结果也表明糖尿病小鼠和病人的cPWWP2A均上调明显(图1)。



来第一个抢占沙发评论吧!