原创:
血管周细胞和内皮细胞(ECs)之间的串扰对微血管稳定和重塑至关重要;然而,串扰经常被糖尿病破坏,导致严重甚至致命的血管损伤。环状RNA是一类内源性RNA,可调节几种重要的生理和病理过程。3月26日复旦大学附属上海医学院眼科与耳鼻喉科医院及南京医科大学附属眼科医院在PNAS上发表了“Targeting pericyte–endothelial cell crosstalk by circular RNA-cPWWP2A inhibition aggravates diabetes-induced microvascular dysfunction”,文章显示糖尿病相关的压力上调周细胞中的cPWWP2A表达,但在EC中没有。体外研究表明,cPWWP2A直接调节周细胞生物学,但通过携带cPWWP2A的外泌体间接调节EC生物学。cPWWP2A充当内源性miR-579海绵以隔离和抑制miR-579活性,导致血管生成素1、occludin和SIRT1的表达增加。体内研究表明,cPWWP2A过表达或miR-579抑制可减轻糖尿病引起的视网膜血管功能障碍。相反,通过沉默cPWWP2A或过表达miR-579来抑制cPWWP2A介导的信号传导会加重视网膜血管功能障碍。总的来说,这项研究揭示了周细胞和EC交流的机制,cPWWP2A或miR-579表达的干预可为治疗糖尿病微血管并发症提供机会。
研究思路
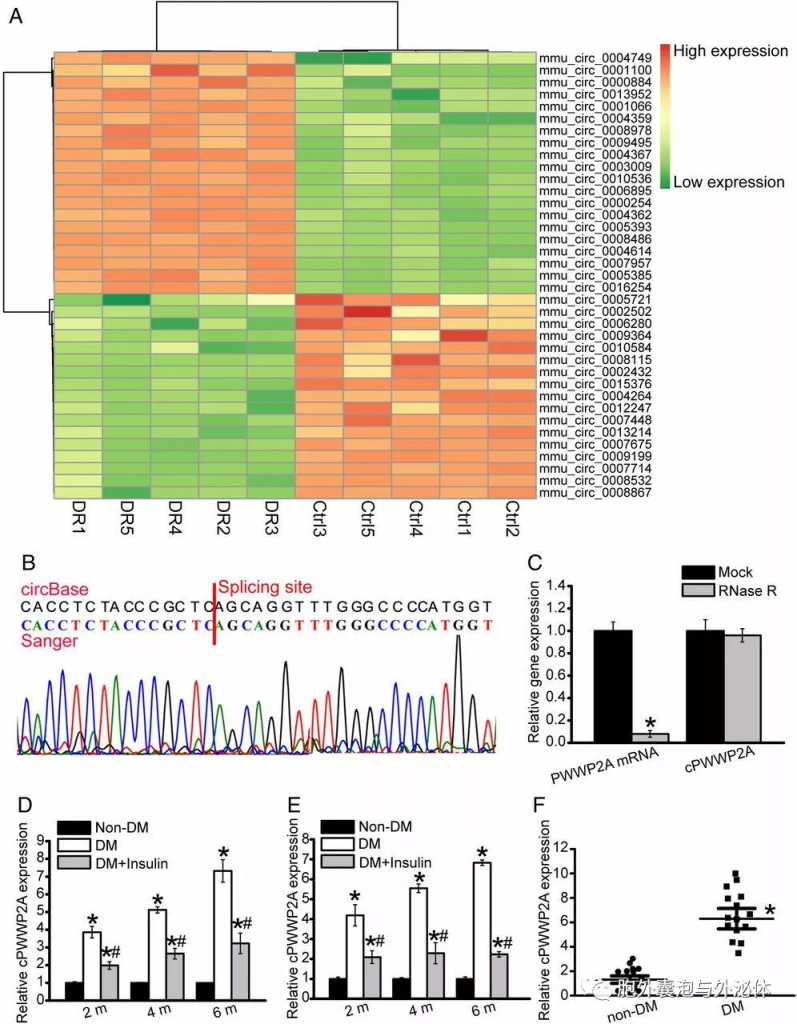
Figure 1:circRNA表达谱分析将cPWWP2A鉴定为糖尿病视网膜病变的潜在调节因子。 (A)进行分层聚类分析以获得非糖尿病视网膜和糖尿病视网膜之间的circRNA表达谱的概述。 (B)进行Sanger测序以检测视网膜cPWWP2A表达。获得的cPWWP2A序列与circBase中注释的cPWWP2A序列一致。 (C)用RNase R消化视网膜RNA,然后用cRW-PCR检测cPWWP2A表达。检测到PWWP2A mRNA作为RNase R敏感性对照。 (D和E)进行qRT-PCR以检测STZ诱导的糖尿病视网膜,db/db糖尿病视网膜及其非糖尿病对照中的cPWWP2A表达,有或没有胰岛素治疗糖尿病与糖尿病加胰岛素相比。 (F)进行qRT-PCR测定以检测糖尿病患者的纤维血管膜和非糖尿病患者的特发性视网膜前膜中的cPWWP2A表达。
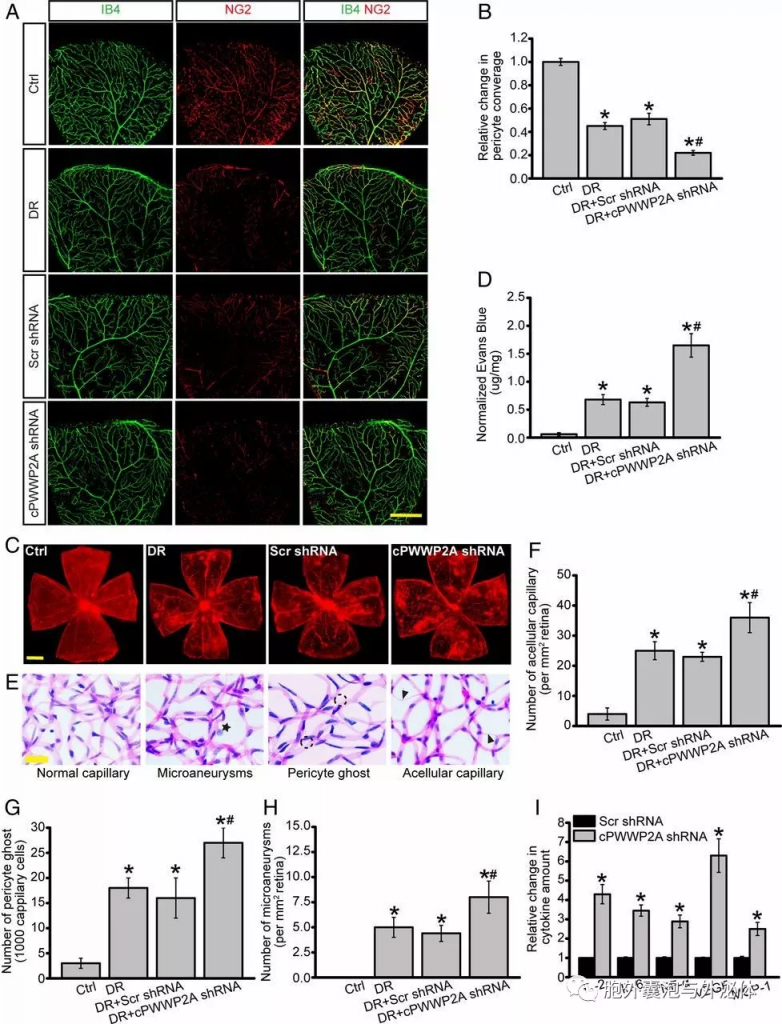
Figure 2:cPWWP2A在体内调节糖尿病诱导的视网膜血管功能障碍。 (A和B)平板视网膜被IB4和NG2双重染色,以显示非糖尿病C57BL/6小鼠中覆盖视网膜脉管系统的周细胞,糖尿病小鼠无玻璃体或玻璃体内注射乱序(Scr)shRNA或cPWWP2A shRNA。(C和D)将非糖尿病或糖尿病小鼠用伊文思蓝染料注入2小时。使用具有相同增益设置的4x镜片拍摄整个视网膜脉管系统的平铺扫描图像。 (E-H)进行视网膜胰蛋白酶消化以检测无细胞血管,周细胞重影和微动脉瘤的数量。(I)进行ELISA以检测视网膜裂解物中IL-2,IL-6,TNF-α,VEGF和MCP-1的量。
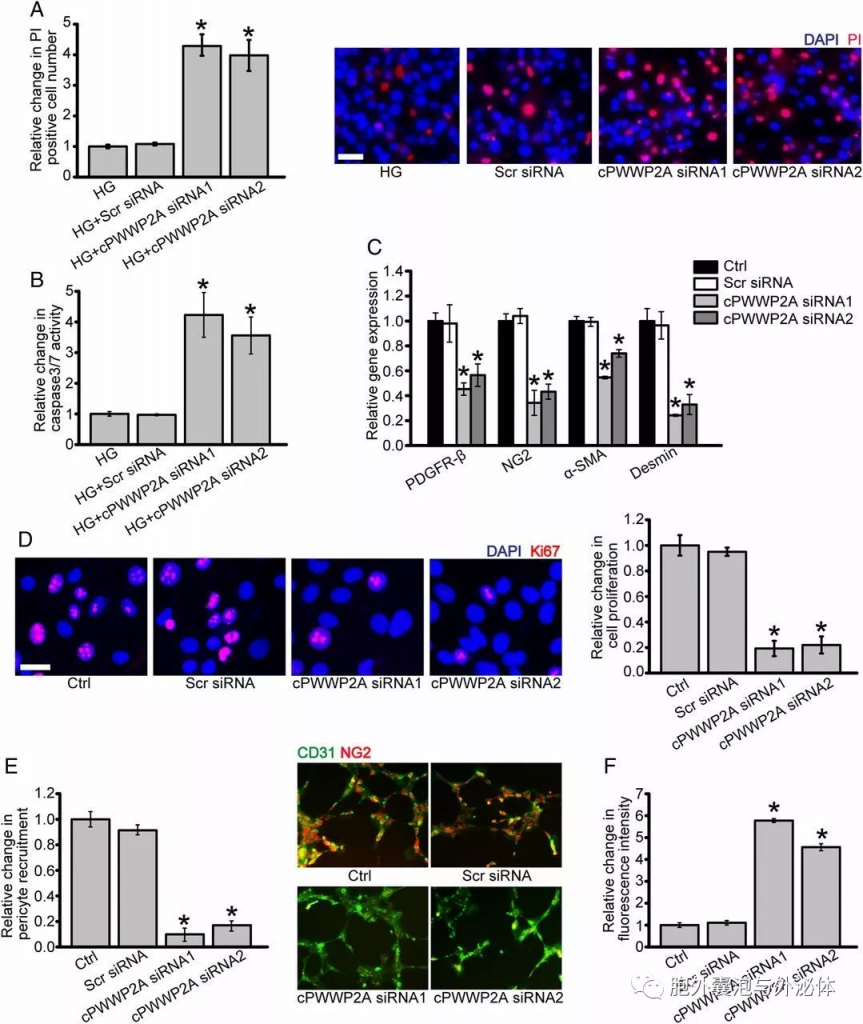
Figure 3:cPWWP2A在体外调节视网膜周细胞功能和周细胞-EC串扰。 (A和B)用乱序(Scr)siRNA,cPWWP2A siRNA1或-2转染周细胞,或不处理,然后暴露于葡萄糖。通过PI染色(A)和半胱天冬酶3/7活性(B)测定凋亡细胞。 (C和D)用Scr siRNA,cPWWP2A siRNA1或-2转染周细胞,或不处理。进行qRT-PCR以检测周细胞标记物的表达。 (E)野生型,cPWWP2A siRNA1,cPWWP2A siRNA2或Scr siRNA转染的周细胞通过血清饥饿同步,然后与HRVEC共培养。(F)将周细胞与HRVEC共培养以评估内皮屏障功能。
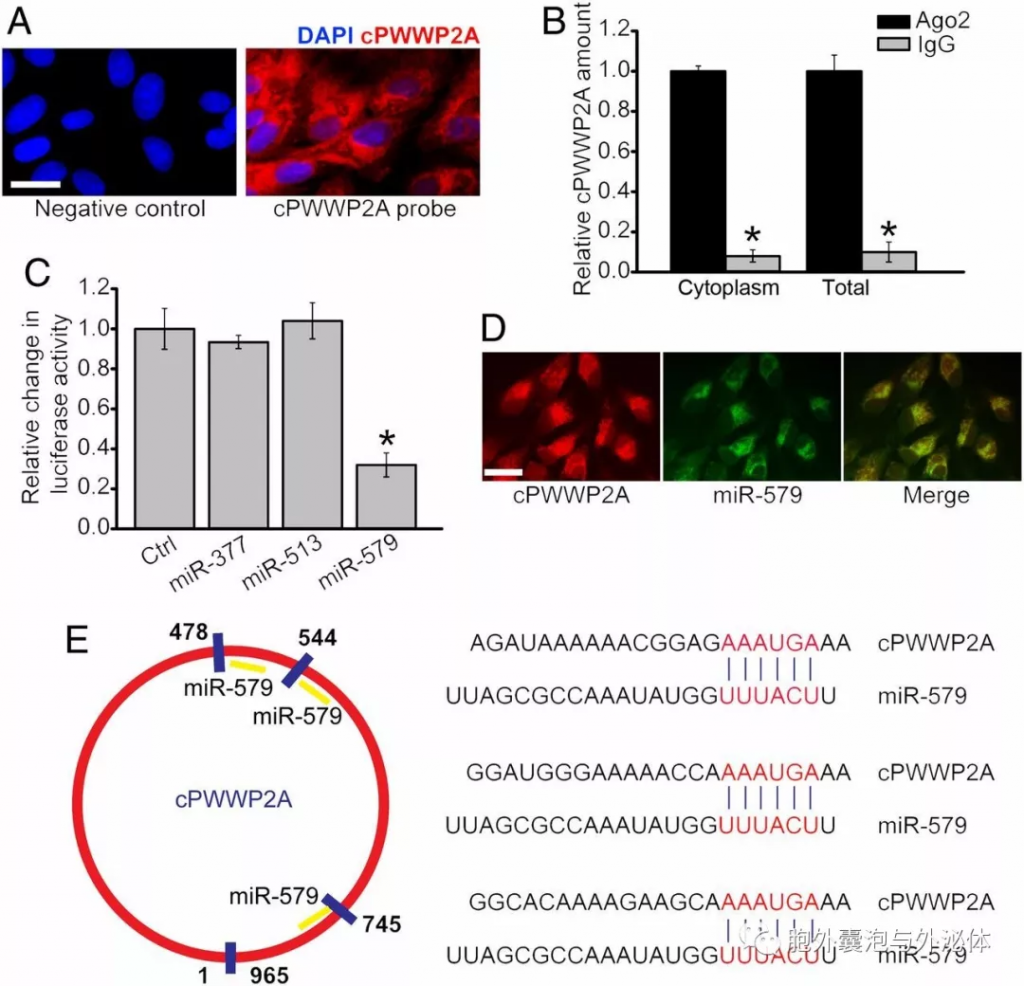
Figure 4:cPWWP2A通过在体外充当miRNA海绵来调节周细胞功能。 (A)进行RNA-FISH测定以检测周细胞中cPWWP2A的表达。 (B)从周细胞中分离细胞质和总细胞部分,并使用Ago2或IgG抗体进行免疫沉淀。通过qRT-PCR检测免疫沉淀物中的cPWWP2A量。 (C)将cPWWP2A的完整序列克隆到pGL3萤光素酶报告基因中以构建LUC-cPWWP2A载体。用不同的miRNA模拟物共转染周细胞LUC-cPWWP2A。在转染后通过双荧光素酶测定检测荧光素酶活性。 (D)进行RNA-FISH测定以检测周细胞中cPWWP2A和miR-579的表达。 (E)示意图显示了miR-579对cPWWP2A转录物的推定结合位点。
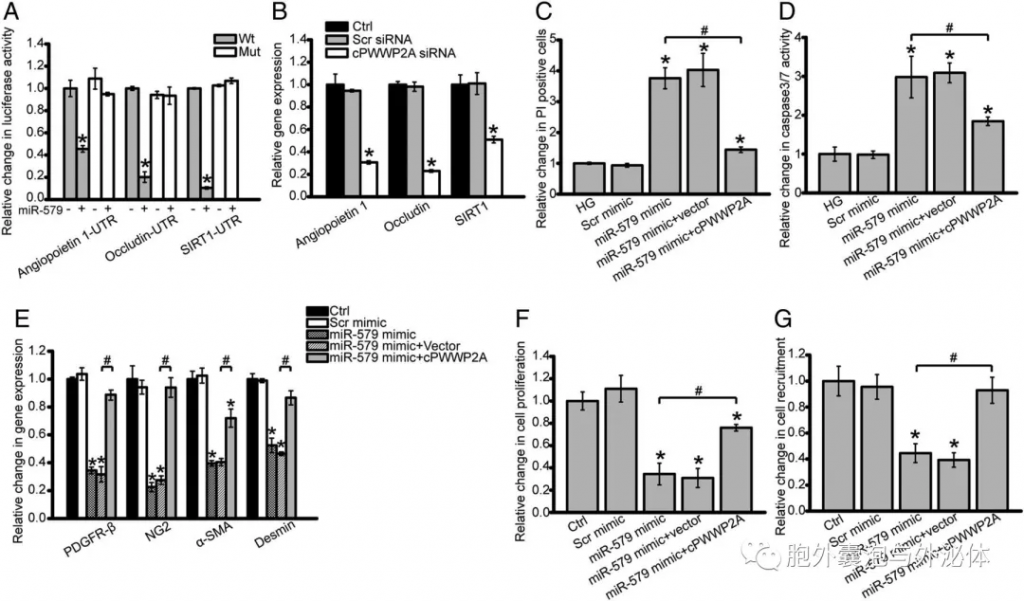
Figure 5:cPWWP2A-miR-579-血管生成素1/occludin/SIRT1网络在体外调节周细胞功能和周细胞-EC串扰。 (A)周细胞共转染野生型或突变体血管生成素1-UTR,occludin-UTR,SIRT1-UTR,有或没有miR-579模拟物。转染后检测荧光素酶活性。 (B)用cPWWP2A siRNA,乱序(Scr)siRNA转染周细胞,或不处理。转染后进行qRT-PCR以检测血管生成素1,occludin和SIRT1的表达。 (C-G)如图所示处理周细胞通过PI染色或胱天蛋白酶3/7活性测定凋亡细胞。进行qRT-PCR以检测周细胞标志物的表达,包括PDGFR-β,NG2,α-SMA和Desmin。通过Ki67染色检测细胞增殖。将周细胞用NG2和CD31染色以标记周细胞和HRVEC,并确定HRVEC上募集的周细胞的数量。
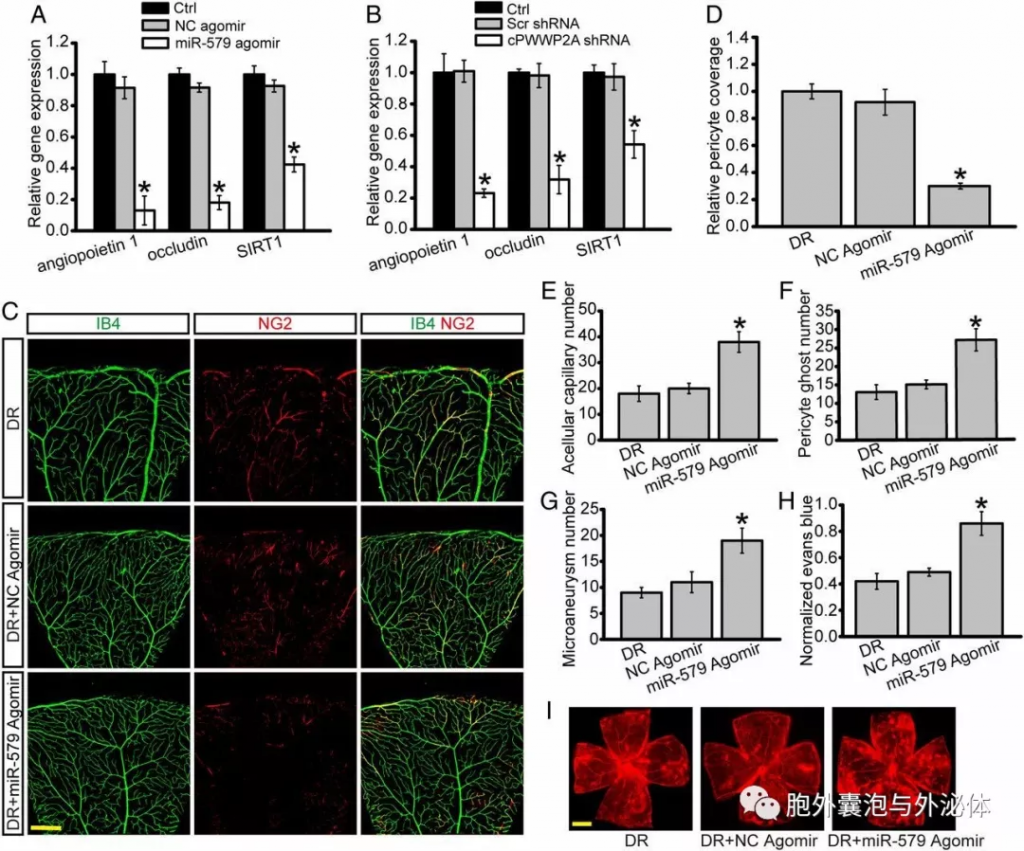
Figure 6:cPWWP2A-miR-579-血管生成素1/occludin / SIRT1网络调节体内视网膜血管功能障碍。(A和B)糖尿病C57BL/6小鼠接受玻璃体内注射miR-579 agomir,阴性对照agomir,cPWWP2A shRNA,乱序shRNA或未处理1个月进行qRT-PCR以检测血管生成素1,occludin和SIRT1表达。糖尿病C57BL/6小鼠接受玻璃体内注射miR-579 agomir,NC agomir,或每月一次未处理。 (C和D)进行视网膜胰蛋白酶消化以检测无细胞血管,周细胞重影和微动脉瘤(E-G)的数量。注入染料使用镜头拍摄整个视网膜的平铺扫描图像。显示了平面视网膜的代表性合成图像以及伊文思蓝色泄漏的量化结果。红色荧光是伊文思蓝信号(H和I)。
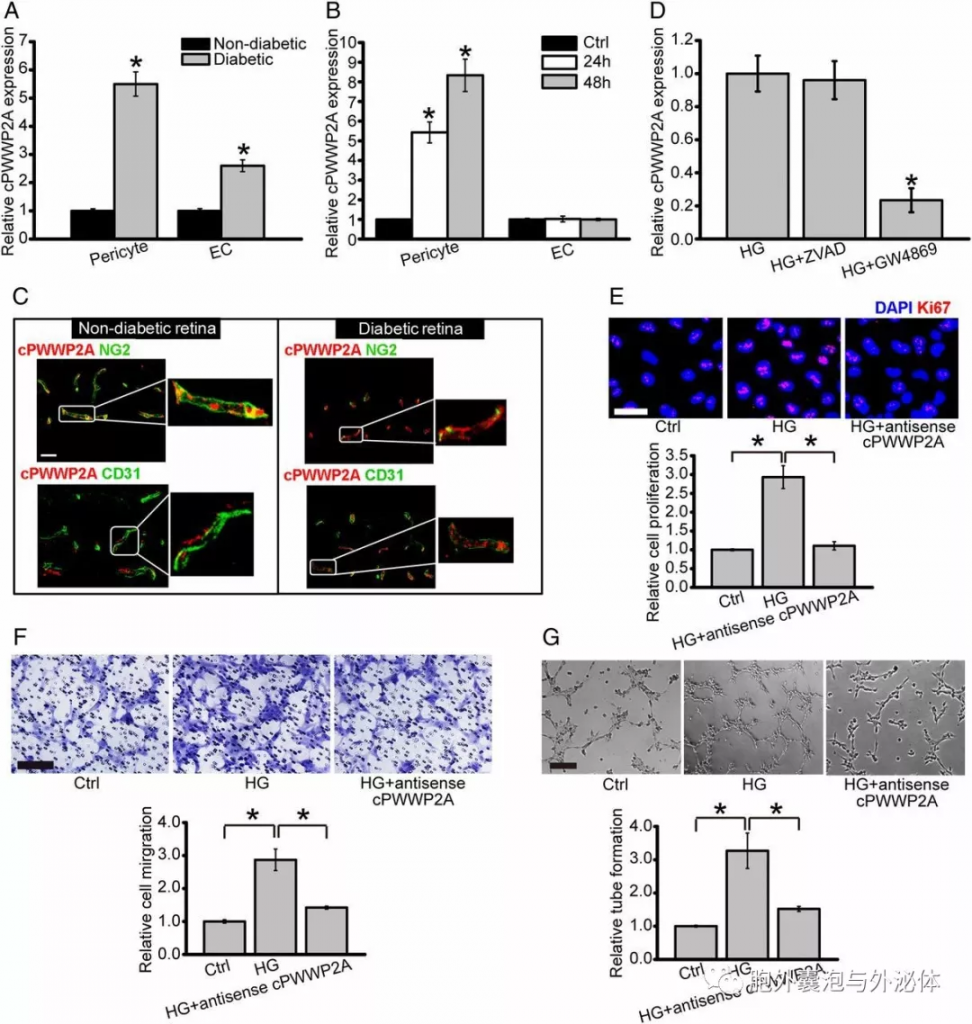
Figure 7:在周细胞和EC之间转移cPWWP2A调节周细胞-EC串扰。 (A)从非糖尿病和糖尿病视网膜中分选周细胞和EC。通过qRT-PCR测定周细胞和EC中的cPWWP2A表达。 (B)从非糖尿病视网膜中分选周细胞和EC,然后暴露于30mM葡萄糖,或不进行处理。通过qRT-PCR测定周细胞和EC中的cPWWP2A表达。 (C)在非糖尿病和糖尿病视网膜中用cISH检测cPWWP2A表达的代表性CD31染色或NG2染色。 (D)用或不用凋亡抑制剂Z-VAD-FMK(ZVAD)或N-SMase抑制剂GW4869预处理高葡萄糖(HG)处理的周细胞培养基。然后将EC与从上述培养基中分离的囊泡一起温育。通过qRT-PCR测定EC中的cPWWP2A表达。 (E-G)将周细胞与含有葡萄糖的培养基一起温育。然后将具有或不具有cPWWP2A反义转录物的周细胞培养基与cPWWP2A -/-EC孵育。使用Ki67染色(E)在培养后检测到EC增殖。使用Transwell测定法(F)和生长因子减少的基质胶(G)在培养后检测EC迁移和管形成。
结论
视网膜微血管系统主要包括周细胞和ECs,高血糖导致周细胞中cPWWP2A表达增加,已显示周细胞在调节血管稳定性和重塑中起关键作用。在DR的早期阶段,周细胞丢失被证明是最早的组织病理学标志。cPWWP2A过表达可以在体外保护周细胞免受高葡萄糖诱导的损伤。在DR的增殖期,视网膜新血管形成不仅涉及EC的增殖,迁移和成熟,还涉及周细胞的增殖和募集。然而,周细胞的不同步或不充分增殖和募集会影响新血管的成熟,导致血管脆弱和渗漏。cPWWP2A表达的异常损害周细胞生物学,包括细胞增殖,募集和分化,这可能影响新血管的成熟。因此,通过调节周细胞生物学,cPWWP2A参与糖尿病诱导的视网膜血管功能障碍就不足为奇了。由于高血糖应激,EC通常经历从正常静止表型到凋亡和活性表型的表型转换。来自周细胞的培养基影响EC的增殖,迁移和管形成能力。高葡萄糖诱导的cPWWP2A可以从周细胞转移至EC,cPWWP2A在周细胞中的干预将影响EC的血管生成作用,表明cPWWP2A介导的信号传导在调节周细胞-EC串扰中也起重要作用。
视网膜微血管是高血糖损伤的早期和普遍目标。在糖尿病视网膜中,cPWWP2A沉默减少视网膜脉管系统中的周细胞覆盖并加重视网膜血管功能障碍,如血管细胞损失增加,无细胞血管和动脉瘤形成所示。血管功能受损会增加血管通透性和炎症。cPWWP2A沉默也加重了糖尿病引起的视网膜血管渗漏和炎症。相比之下,cPWWP2A过表达可减轻糖尿病引起的视网膜血管功能障碍。总的来说,cPWWP2A表达与视网膜周细胞生物学和血管稳态紧密相关。推测cPWWP2A上调被证明是对抗高血糖症应激的补偿性和有益的反应, cPWWP2A上调可增加周细胞的增殖和募集,保护周细胞免受糖尿病相关的压力,并延缓视网膜血管功能障碍的发展。
以前的研究表明,功能性circRNA通过作为细胞质miRNA海绵,RNA结合蛋白螯合剂或核转录调节因子而发挥调节功能。cPWWP2A主要在周细胞的细胞质中表达,特别是被Ago2拉低,提供了cPWWP2A作为miRNA海绵的可能性。体外研究和体内研究表明,cPWWP2A对miR-579的干预会影响周细胞生物学,周细胞-EC串扰和糖尿病引起的视网膜血管功能障碍。此外,外源性miR-579干预可能超过cPWWP2A的miRNA海绵功能。因此,cPWWP2A或cPWWP2A介导的下游信号传导的干预是用于改善DR表型的有希望的治疗策略。鉴于cPWWP2A已在DR中过表达,cPWWP2A信号传导的下游成员miR-579的抑制对于治疗糖尿病相关的视网膜血管功能障碍将具有更大的翻译意义。
血管生成素1(Ang-1)是血管形成的主要调节剂。它由周细胞分泌并激活ECs表达的酪氨酸激酶受体Tie-2,该信号可以稳定新形成的血管。Occludin是一种跨膜紧密连接蛋白,有助于多种细胞功能,如控制屏障特性,细胞迁移和增殖。SIRT1功能的丧失阻碍了内皮细胞的血管生成和分支形态发生。基于上述证据,知道血管生成素1/occludin/SIRT1参与血管重塑过程中周细胞或EC生物的调节。cPWWP2A过表达成为miR-579的汇,并释放miR-579对cPWWP2A的抑制作用.因此,cPWWP2A-miR-579-血管生成素1/occludin/SIRT1网络在体内调节视网膜血管功能障碍就不足为奇了。
总之,这项研究揭示了糖尿病引起的微血管功能障碍的机制。该机制涉及周细胞中cPWWP2A,miR-579和血管生成素1 / occludin / SIRT1的协调调节,这也导致cPWWP2A通过外泌体从周细胞转移至EC后的EC生物学改变。
全文链接:
https://pan.baidu.com/s/1z6UuC3bDh16SboJI69Btnw
提取码: dqit





来第一个抢占沙发评论吧!