环状RNA几种翻译模式,初步可将真核生物环状RNA翻译归类为:
1. 内部核糖体进入位点(IRES)介导的翻译
2. 非IRES介导的翻译:
滚环扩增翻译(RCA)
由UTR或其他翻译激活原件诱导的翻译
m6A修饰后的翻译
今天来给大家介绍一下如何构建minigene表达系统。minigene表达系统能够在真核细胞中有效的生成目的环状RNA,进而通过IRES的介导表达目标蛋白。这种minigene表达系统是研究环状RNA生成机制和翻译功能的重要工具。

小知识
我们知道,真核生物mRNA的整个翻译过程包括起始、延伸和终止3个阶段。起始阶段一般指核糖体识别起始密码子(AUG),是翻译调控的关键。起始阶段可分为两种方式:扫描模型和内部起始模型。
扫描模型中翻译起始因子与Kozak序列结合,使核糖体与5’末端帽子结合,然后沿着mRNA扫描直至AUG;而内部起始模型绕过5’末端帽子,通过IRES元件,使核糖体结合到mRNA的内部区域,即直接结合到AUG或其上游,进而起始翻译过程。
内部核糖体进入位点(IRES)具备募集核糖体并实现核糖体组装和后续阅读框蛋白编码的功能。此外,IRES也能够与核糖体RNA形成碱基对,类似于在细菌翻译起始的Shine-Dalgarno序列。因此,IRES作为一种翻译元件在研究蛋白编码过程中发挥着重要的作用。
研究目的
通过构建特定的含有IRES和GFP开放阅读框(ORF)的minigene表达系统,研究反向剪切成环的机制和效率;进一步观察形成的环状RNA能否有效表达目的蛋白。
研究思路
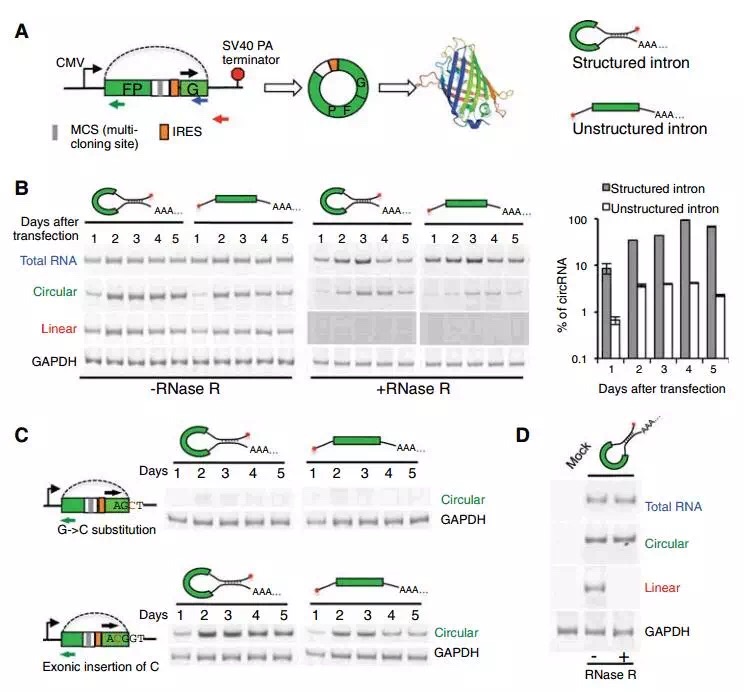
研究者构建了含有单外显子(两端是哺乳动物剪切位点AG-GT)的minigene,GFP的ORF序列分开成两部分,反向排列,研究能否在经典的剪接位点成环;并且将IRES插入到起始密码子的上游,用来检测生成的环状RNA的翻译功能(图1A)。
为了验证minigene两侧的Alu序列在成环中的作用,分别构建两种minigene:相同的上游序列和不同的下游序列,分别形成配对和不能配对的dsRNA结构(图1A)。
Western blot和免疫荧光实验检测minigene生成的环状RNA蛋白表达情况,并且进一步研究PolyA结构对翻译过程的影响。
研究结果
1/minigene促进环状RNA形成
研究者检测到两种minigene在细胞转染1天后就有环状RNA生成,在3-4天时达到最高值。minigene两侧互补对环状RNA的形成有明显的促进作用,大约提高10-30倍的效率(图1B)。但是这种能够形成dsRNA结构的配对序列不是形成环状RNA所必须的。将5’剪切位点突变后(GT→CT),反向剪切没有发生,环状RNA则不能形成(图1C)。
2/验证反向成环的发生/
为了验证环状RNA的保守性,研究者又将含人类内含子的minigene转染到果蝇S2细胞中,发现同样能够有效的反向剪切生成环状RNA,预示这种机制在脊椎和无脊椎动物中可能存在保守性(图1D)。
A: Minigene示意图:GFP蛋白分开位于外显子两端;转录由CMV promoter驱动,由SV40 PA终止;构建了可以内含子配对和不能配对的两种minigene;
B: 转染293T细胞后1-5天的总RNA纯化,再分别用RNase R处理和不处理,设计不同引物的RT-PCR检测Minigene转录生成的RNA;并且研究环状RNA占总RNA的比例;
C: 将minigene剪切位点突变后,观察RNA的形成情况;
D: 果蝇S2细胞中的环状RNA形成情况。
3/环状RNA的表达研究/
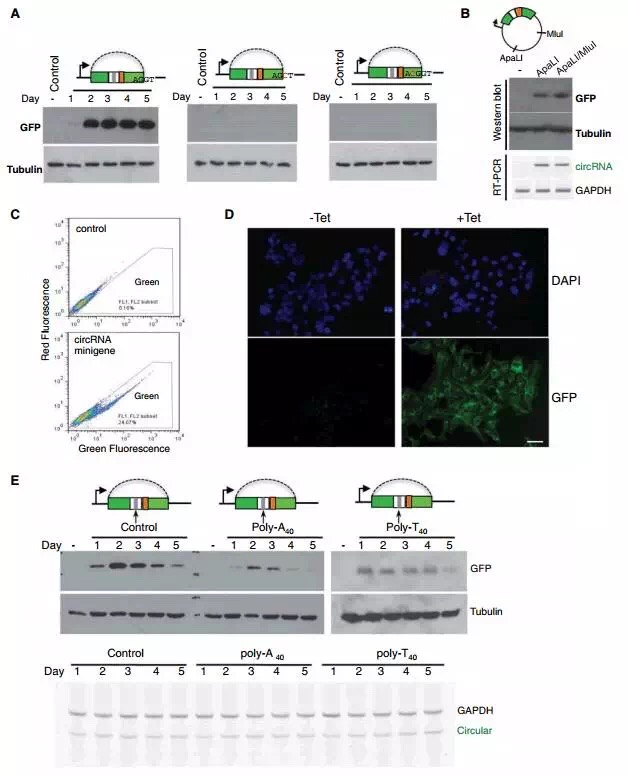
研究者发现内含子配对/不配对的minigene转染细胞后能够稳定表达GFP蛋白,表明环状RNA能够和线性mRNA一样,在真核细胞内直接着编码蛋白。此外,5’剪切端突变后,蛋白编码能力消失(图3A)。
为了证实表达GFP蛋白全部来自环状RNA,研究者在质粒backbone部分引入两个酶切位点消化,排除转录过程中小几率生成的含有整个ORF的长RNA。利用ApaLI或者ApaL1/MluI消化质粒,转入细胞后,RT-PCR和Western blot显示检测到环状RNA和表达的GFP蛋白(图3B)。
流式细胞实验显示转染2天后,大约有25%的细胞表达GFP蛋白(图3C),推测可能和瞬时转染效率,环状RNA生成和蛋白合成速度较慢等综合因素有关。免疫荧光实验显示,在稳定转染体系中几乎所有细胞都有GFP蛋白表达(图3D)。
minigene插入poly(A40)、poly(T40)后,GFP蛋白表达水平降低,这一结果和真核生物线性mRNA翻译的情况不同。研究者推测在IRES上游插入重复序列,会对IRES介导的翻译产生干扰和抑制作用(图3E)。
A: Western blot检测野生型和两种剪切位点突变型minigene转染细胞中的GFP蛋白;
B: RT-PCR和Western blot检测单酶切消化minigene后转染细胞中的环状RNA和GFP蛋白;
C: 流式细胞技术检测表达GFP蛋白的细胞;
D: 免疫荧光实验检测表达GFP蛋白的细胞;
E: RT-PCR和Western blot检测minigene插入poly (A40),poly (T40),转染细胞后的环状RNA和GFP蛋白。
小结
要想构建特定minigene,在人类和果蝇细胞内有效成环和表达需要考虑以下几点:
1> 5′剪切位点(5′ ss)and 3′ ss遵循GT-AG规律,5′ ss突变后,反向剪切不能发生,不能形成特定环状RNA。
2> minigene两侧的能够互补配对的Alu序列对反向剪切有促进作用,但不是必须的。
3> 一般都要用RNase和剪切位点突变处理,对比前后的环状RNA情况差异,验证反向剪切成环的发生。
4> 为了研究环状RNA的表达,需要插入目的蛋白ORF和翻译启动元件IRES,并且将ORF分开,保证成环后才能行使功能,排除线性RNA蛋白表达的可能性。
5> 与线性mRNA翻译不同,PolyA结构序列对翻译的效率没有明显的作用。
好了,我们已经介绍了两种环状RNA的表达情况,以及构建表达系统的基本因素,后续将继续介绍真核生物内源性环状RNA的翻译情况。
参考文献:
[1] Wang Y, Wang Z. Efficient backsplicing produces translatable circular mRNAs. RNA 2015; 21:172–179.



来第一个抢占沙发评论吧!